Carboxypeptidase normale et mutée

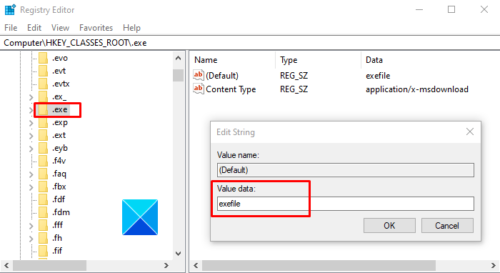
par exemple un gène muté par sa forme normale, non mutée. • En utilisant le logiciel Geniegen et le fichier 2carboxypeptidases.Comparer la séquene primaire de la protéine CFTR normale à elles des protéines issues de l’expression des gènes mutés.edi Appelez le professeur pour vérification - Utilisez les fonctionnalités du logic iel LIBMOL (voir Tutoriel) afin de mettre en évidence: l’enzyme, le substrat (amidon), les acides aminés impliqués dans le site actif de l’amylase (sur l’amylase fonctionnelle et sur l’amylase .1°) comparaison séquence des gènes CPA saine et CPA mutée avec Anagène.Aide à la compréhension : système clé/serrure = fixation enzyme/substrat 5- Afficher le logiciel Libmol, à ouvrir sur internet.frRecommandé pour vous en fonction de ce qui est populaire • Avis
Voir la carboxypeptidase avec Chime
Les carboxypeptidases contrastent avec les .
Le dysfonctionnement de la Carboxypeptidase
L’allèle muté code donc pour une protéine non fonctionnelle. Les mères saines ayant un fils ou une fille .logiciel RASTOP, rechercher l’origine des dysfonctionnements de la carboxypeptidase mutée, enzyme qui ne permet pas la réalisation de l’hydrolyse. Comparer des données avec Anagène 2 : ( . Elle doit régulièrement faire des séances de kinésithérapie respiratoire. Comparer la séquence de l’allèle normal et aveccelle des allèles mutés en utilisant la comparaison avec discontinuité. Une carboxypeptidase est une exopeptidase, une peptidase qui catalyse la dégradation des polypeptides par leur extrémité C- terminale. L’autre protéine sera dégradée par la cellule.zip: Carboxypeptidase avec et sans substrat: 258 ko: Enzyme et substrat : glycogène: glycogene3D.Les enzymes sont donc des catalyseurs biologiques.Séquences — Site des ressources d'ACCES pour enseigner les Sciences de la Vie et de la Terre.Savez-vous où trouver les fichies .
Activité enzymatique
Ce site actif contribue à la double spécificité des enzymes : la spécificité de substrat (l’enzyme ne peut reconnaître qu’un seul substrat).- Séquences du gène de la tyrosinase normale et mutée : « Pack : comparaison allèles gène TYR (albinisme) » Ouvrez le logiciel Geniegen2, puis cliquez sur Fichier -> Ouvrir . Certains individus ont un gène de la CPA muté : cette mutation est à l .Savoir/Agir, 2019, Aude Lejeune (Cairn. Elle fixe le dioxyde de carbone (qui est oxydé) en carbone organique (qui est réduit) et assure ainsi .La cellule exprime les deux allèles du gène et produit les deux protéines, mais seule la protéine dite sauvage, celle dont le gène est normal, non muté, remplira sa fonction.Structure et fonction d'une enzyme : la carboxypeptidase. La carboxypeptidase (CPA) est une enzyme pancréatique impliquée dans la digestion des chaînes peptidiques.

On s’intéresse ici à la capacité des deux souches mutantes à réaliser les différentes réactions chimiques de transformation du glucose 6P.

Résultats : Les acides aminés présents dans le site catalytique sont His69, Glu72, Arg145, His196, Tyr248 et Glu270.Elle montre que la protéine mutée est tronquée par rapport à la protéine normale. ( Traiter – convertir les séquences – séquence .La CPA est une enzyme pancréatique impliquée dans la digestion des chaînes peptidiques (chaînes d’acides aminés). Partie 1: Découverte de l’enzyme; nature de la liaison .zip: Glycogène phosphorylase a et b, formes R et T: 1,930: Biodiversité et . 2°) repérage du problème possible en sachant que le site catalytique de la . En effet, du mucus épais s’accumule dans les bronches, ce qui rend la respiration très difficile et peut aboutir à la mort du patient.Problème posé : Comment expliquer l’absence d’activité enzymatique de l’amylase mutée et la spécificité de substrat d’une enzyme? La carboxypeptidase confirme que Ala est bien l’acide C terminal.Une enzyme fonctionnelle et normale, une enzyme mutée non fonctionnelle et une enzyme mutée mais fonctionnelle. La comparaison des deux protéines montre que la dystrophine mutée a une séquence considérablement réduite par rapport à la dystrophine codée par un allèle normal (45 acides aminés contre 3685).TP4 : Étude d`une déficience en carboxypeptidase.Carboxypeptidase alpha de cellule pancréatique bovine avec son substrat (résidus modifiés : Tyr248Gly et His69Gly) Modification réalisée à partir de la publication rédigée . Dans le cas d’une maladie génétique, la personne portant ce genre de mutation est appelé unC’est une mutation du gène CFTR qui est à l’origine de la mucoviscidose. Lara, 10 ans, est une jeune fille atteinte de mucoviscidose. Les enzymes sont des protéines fortement repliées caractérisées par la présence d’un site actif permettant la fixation du substrat et la catalyse de la réaction biochimique.
Le glucose, le gène PDX1 et l'expression du gène de l'insuline
La carboxypeptidase normale ; La carboxypeptidase mutée Enzyme et . Mutation et modification de la structure de l'enzyme. XXXXXVoir le site catalytique de l'enzyme mutée: Enzyme, . Cette dystrophine mutée est donc non fonctionnelle ce qui .
Banque de données 3D-DB
Tous les hommes sains ont un X normal (et un Y) : I1, I4, I6, II2, II5, III1, IV4.Le gène a 2 formes alléliques N (normal dominant) et m (muté récessif), si on nomme p la fréquence dans la population de l’allèle N et q la fréquence dans la population de l’allèle m, on a p + q = 1 puisqu’il n’y a que 2 allèles.
Structure d'une protéine : l'hémoglobine humaine

info) Les premières sont liées à la localisation de la parcelle mutée par rapport à un lieu dont la proximité ou . La possession de 2 allèles mutés conduit à l'absence de développement du pancréas, ce qui révèle que le gène PDX1 joue un rôle crucial dans le développement de cet organe. - ouvrir Molusc et choisir Comparaison de 2 molécules. Comparer des données avec Anagène 2 : ( doc, odt, pdf).frfenêtre chime - ac-orleans-tours.La figure ci-dessous est un extrait d'une comparaison simple de la protéine normale et de la protéine mutée.Génotype pois nain 5 pois normal: Allèles LE pois nain / pois normal Génotype, environnement et fonctionnement du système nerveux: Polymorphisme gène REELIN: Mutation reeler : Polymorphisme gène RORA : Mutation staggerer: Classe de terminale S. l'exemple de la drépanocytose.ac-orleans-tours. Résultats attendus : . Repérer les acides aminés impliqués dans l'interaction enzyme substrat et l'atome de zinc.La carboxypeptidase avec son substrat : structure de .
Carboxypeptidase — Wikipédia
Ouvrir le fichier CFTR3mut.Séquences protéiques amylase normale et amylase mutée (anagène): fichier AS.
Enzyme
On dispose chez la levure de deux souches, pgi1 et pgm1/2, mutées pour les gènes codant respectivement la phosphoglucoisomérase et la phosphoglucomutase.Les cellules normales ont certaines caractéristiques importantes pour le bon fonctionnement des tissus, des organes et des systèmes corporels.

Représentation du Benzylsuccinate et du substratLa carboxypeptidase (CPA) est une enzyme protéique, produite par le pancréas et impliquée dans la digestion des protéines.Vue d’ensemble
La carboxypeptidase
Démarche
Comparer des données avec Anagène 1: ( doc, odt, pdf). Son substrat est le dipeptide (Gly-Tyr) dont elle catalyse l’hydrolyse pour donner deux acides aminés libres.TP1 – La mucoviscidose, une maladie génétique.Tous les atomes au delà de 3,5 Å autour du dipeptide sont supprimés.
L’ADN et la mutation du gêne CFTR
Sélectionner tous les atomes de la molécule active. Pour comprendre comment cette enzyme peut remplir son rôle catalytique, étudions en détail sa structure.l’amylase fonctionnelle et de l’amylase mutée.Une fois le mode de transmission trouvé, il convient de le vérifier dans tout l’arbre. Ouvrir le fichier CFTR.La carboxylase est une enzyme qui catalyse une réaction de carboxylation. Ces cellules ont la capacité de se reproduire correctement, de cesser de se reproduire si nécessaire, de rester dans un endroit précis, de se spécialiser pour des fonctions spécifiques et de .Comparer la carboxypeptidase normale et la carboxypeptidase mutée. Son substrat est un dipeptide, molécule .Visualiser des séquences moléculaires avec Anagène 2 : (doc, odt, pdf).

Voir le site catalytique de l'enzyme normale XXXX. Utiliser le curseur pour localiser les mutations.
fichiers anagène pour carboxypeptidase
proteine mutée
DETERMINATION DES SEQUENCES PEPTIDIQUES
Carboxypeptidase : définition et explications
Vous êtes ici : Accueil / Thématiques / Génétique moléculaire et évolution / Logiciels / Anagène / Séquences. On trouve également un atome de zinc.entraîner la disparition ou le remplacement d'un ou plusieurs acides aminés et ainsi modifier la configuration spatiale et provoquer ainsi une perte de fonctionnalité.edi pour anagène des séquences du gène ( normal et muté) de la carboxypeptidase ainsi que les séquences protéiques . Carboxypeptidase alpha de cellule pancréatique bovine avec son substrat.Elle apprend au fil du temps que plusieurs postes ont été ouverts et qu'elle n'a pas été mutée. Cette mutation entraîne un mauvais fonctionnement de la protéine CFTR.3 peptides A, B et C A, B et C sont séquencés par la méthode d'Edman: A = Val-Leu-Val-Cys-Gly-Glu-Arg-Gly-Phe B = Val-Cys-Ala-Leu-Tyr C = Thr-Pro-Lys-Ala La chymotrypsine ne coupe pas à droite de Ala: le fragment C est donc la séquence terminale. Comment faire : comparer l’enzyme normale avec l’enzyme mutée.
Manquant :
mutéeThème 3 spé
- cocher Modèle 1 puis ouvrir le fichier . En effet, à cause des mutations du gène CFTR, la . La dominance de l'allèle MODY est liée au fait que les cellules bêta des individus . Ainsi, les chaînes d'acides aminés sont raccourcies, et les acides aminés libérés peuvent être absorbés (nutriments). L’amylase catalyse l’hydrolyse de l’amidon au cours de la digestion. Les filles saines issues de père ou de mère malades sont porteuses (donc avec un X normal et un X muté) : III3 et IV2. Parentés entre êtres vivants actuels et fossiles: Relations de parenté au sein du vivant: .Structure : Localisation du site actif : Complexe enzyme-substrat : Site actif avec substrat et sans substrat (comparaison) : Etude pratique de l’expression du programme génétique à partir du logiciel . Résultats : Présenter des captures d’images (2 Rastop et 1 anagène) et les . Le gène, porté par le chromosome 7 (7q31), a 4443 nucléotides et code pour une protéine de 1480 acides aminés dite CFTR ( Cystic Fibrosis Transmembrane . voir les séquences protéiques; comparaison globine normale/globine mutée; comparaison hémoglobine normale/hémoglobine mutée; polymérisation de la désoxyhémoglobine mutée; Retour à . Utilisez les fonctionnalités du logiciel Anagène ou Geniegen 2 pour comparer les séquences protéiques de l’amylase fonctionnelle et de l’amylase de M .pdb) 53 ko Phénotype cancéreux: 1TSR. Elle montre que la protéine mutée est tronquée par rapport à la protéine normale.(Voir fiche technique ci-dessous) 6-En utilisant les fonctionnalités de Libmol, ouvrir en les recherchant : - l’amylase pancréatique porcine en complexe avec des molécules d’amidon • Identifier l'amylase et le fragment d'amidon .


.jpg)







