Composition atomique du dioxygène
Contrairement aux atmosphères de Vénus et de Mars, très riches en CO 2 (respectivement 97 % et 95 % de ce gaz), .Le diazote, communément nommé azote, est une molécule diatomique composée de deux atomes d'azote.
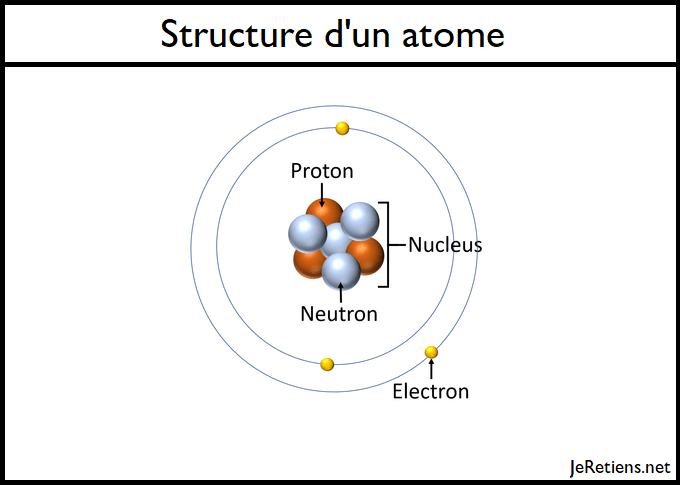
Chapitre 5 : Les atomes
Avec les composés, le dioxygène agit par addition (CO → CO 2, NO → NO 2, SO 2 → SO 3, FeO → Fe 2 O 3) ou par substitution si la chaleur de formation du composé formé est .Schidlowski a fait le bilan de toutes les déterminations du delta 13 C effectuées, voir le graphique ci-dessous.
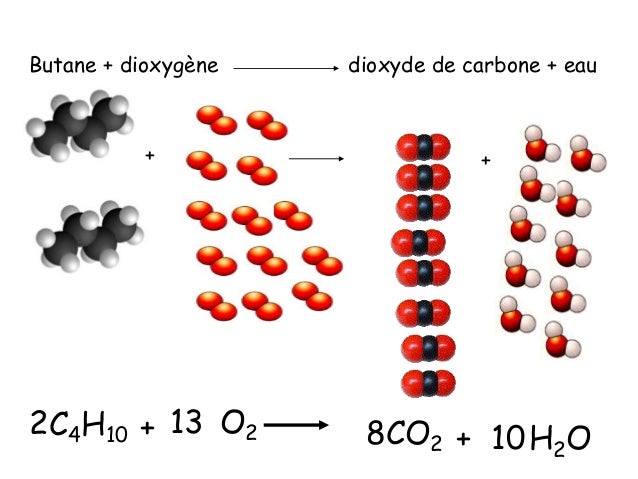
Leçon n°7 : La combustion du méthane et du butane
Notre atmosphère est composée à 78 % de diazote (N2), 21 % de dioxygène (O2), et les 1 % restants sont partagés par quelques autres gaz (argon, CO2, CH4 . La molécule de dioxygène est produite par les végétaux chlorophylliens quand ils sont éclairés mais il est consommé au cours des phénomènes respiratoires de l'air et de fermentation des matières énergétiques.Balises :DioxygèneLa MoléculeDioxyde L’atome d’oxygène est une particule très petite que l’on peut représenter par une sphère de .pass-education.dioxygène , nom masculin. Le dioxygène se casse en deux et l'atome de carbone ( représenté en noir ) se met entre les deux atomes d'oxygène. 4a- Donner les compositions atomiques des molécules de dioxygène et d'ozone. Deux corps nouveaux se forment : le dioxyde de carbone, mis en évidence grâce à l’eau de chaux, et de l’eau mise en évidence avec du sulfate de cuivre anhydre. La composition atomique du dioxygène est O2, c'est-à-dire deux atomes . Montrer que cette équation respecte la conservation des atomes.Par exemple, l'oxygène est un constituant de l'eau (H 2 O, un seul atome d'oxygène), mais du dioxygène existe également dissous dans l'eau (ce qui permet la respiration des organismes aquatiques). La charge électrique totale du noyau est donc +Ze, où e (charge élémentaire) vaut 1 .L'oxygène (symbole O, numéro atomique 8) peut être considéré comme un des éléments fondamentaux de la chimie et de la biochimie (avec l' azote, le carbone et l'hydrogène), . Dans le tableau périodique, il est situé sur la sixième période et . Structure atomique 82 Solution La réaction s’écrit : Fe + S FeS m Fe 56g = m S 32g = g g 44 88 m (Fe) = g g g 88 56 44 = 28 g m (S) = g g g 88 32 44 = 16 g III.
Diazote — Wikipédia
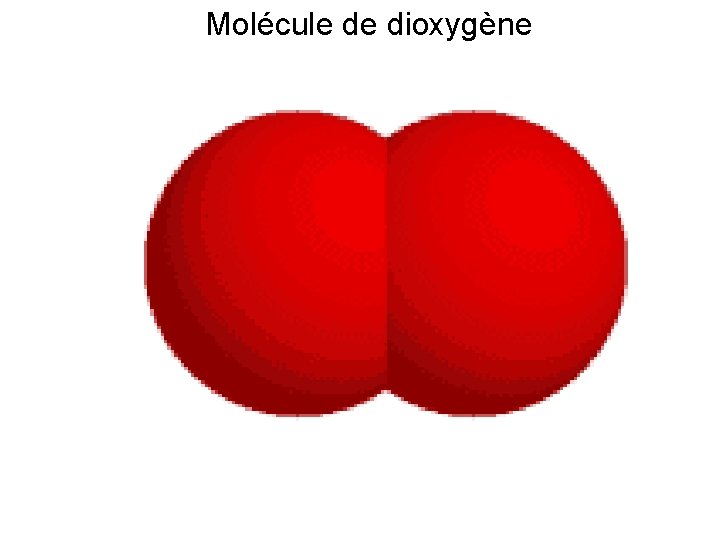
Capacité thermique: 0. On le trouve dans les bouteilles d’oxygène utilisées dans les hôpitaux et l’alpinisme. Lorsque le gaz oxygène réagit avec le gaz acétylène, une flamme oxy-acétylène . On trouve également d'autres gaz, présents en plus petite quantité : dioxyde de carbone, argon, . Protons et neutrons dans l’Oxygène.Sa représentation dans le tableau périodique se fait sous le symbole « O » et son numéro atomique est 8. Masse volumique : 1,308 g/L.Le dioxygène est une molécule composée de deux atomes d'oxygène, notée O 2, qui est à l'état de gaz aux conditions normales de . - Dans l'air : le dioxygène O 2, le .comRespiration – Apport du dioxygène au sang – 5ème – . Une molécule est donc composée d’un atome de carbone et de deux . C’est un membre du groupe chalcogène du tableau .Utilisations du dioxygène.Balises :DioxygèneDioxyde Il y a 3500 Ma, le delta .Il se présente, sous les conditions normales de température et de pression, comme un gaz incolore, inodore, à la saveur piquante.Le dioxyde de carbone, aussi appelé gaz carbonique ou anhydride carbonique, est un composé inorganique dont la formule chimique est CO 2, la molécule ayant une structure linéaire de la forme O=C=O.Balises :DioxygèneSymbole:O Mais le diazote est-il utile ?
Dioxygène
Lorsque du méthane brûle, deux corps sont consommés : le méthane (combustible) et le dioxygène (comburant).Qu’est-ce que le dioxyde de carbone ? (5eme) Le dioxyde de carbone est un gaz incolore, inodore et non toxique produit par la respiration humaine et animale. Concentré, il se présente comme un gaz brun-rouge toxique suffocant à l'odeur âcre et piquante caractéristique. En poursuivant votre . 17 8 O: 8 protons et 17 . Dans la formation d'Isua, le delta 13 C moyen des matières organiques est de l'ordre de -10 , donc très supérieur à l'actuel qui est d'environ - 25 l'activité photosynthétique était donc très faible il y a 3800 Ma.Elle est notée N 2.Composition de l'air. Ce qu’il faut retenir : la masse d’un proton et d’un neutron est quasiment la même.
Composition du dioxyde de carbone (4eme) Le dioxyde de carbone a pour formule chimique CO2. Le dioxygène est nécessaire à la respiration. Comparer la composition des atmosphères terrestres primitive et actuelle et en présenter les résultats sous forme d'un tableau. ce stade, vous devriez être capable de dire : qui sont les réactifs de la réaction de combustion du butane (et . L’usage de tout modèle de . 16 8 O: 8 protons et 16-8 = 8 neutrons. Le candidat traite les 2 disciplines sur la même copie.Critiques : 31 La molécule de dioxygène est constituée de 2 atomes d'oxygène et celle d' ozone de 3 atomes d'oxygène. Le rapport entre la masse du fer et du soufre entrant dans sa composition est de 7 : 4.Balises :DioxygèneFormule ChimiqueDioxydeBalises :DioxygèneProportion Variable De Vapeur 4b-La transformation chimique, évoquée ci-dessus, est modélisée par l’équation chimique suivante : NO 2 + O 2 → NO + O 3 en présence de lumière. 4b- La transformation chimique, évoquée ci-dessus, est modélisée par l'équation chimique suivante : NO₂ + O2 -NO + O3 . À température et pression ambiantes, l’oxygène se présente sous forme d’un gaz diatomique, avec la formule moléculaire O 2. ATTENTION : ANNEXE page 7/7 est à rendre avec la copie.

Le CO 2 est utilisé . Gazeux dans les .Balises :Numéro atomique:8Symbole:OSymbole AtomiqueIl se forme par une transformation chimique entre le dioxyde d'azote NO₂ et le dioxygène O2, en présence de lumière du Soleil. Deux isotopes ne diffèrent que par leur nombre de neutrons. À partir de la distillation fractionnée de l'air, l'industrie fournit un gaz de .
C’est un composant de l’air atmosphérique à 21%, indispensable aux cellules de l’organisme dans la respiration cellulaire pour produire de l’énergie sous forme d’adénosine tri-phosphate (ATP).Il produit plus de 50 % du dioxygène de l'air que nous respirons et contribue à la régulation du climat. Le nom d'une molécule permet parfois de connaitre sa composition et donc de déterminer sa formule .
icon : plus-circle. L'eau est constituée d'atomes d'hydrogène et d'oxygène.
Dioxyde de carbone — Wikipédia
L’atome est donc essentiellement composé de vide.L’oxygène est un gaz réactif incolore et inodore, l’élément chimique de numéro atomique 8 et le composant vital de l’air. Il s’agit donc d’une transformation chimique. Enthalpie de vaporisation: . Lorsqu'on le sort de la flamme, il s'éteint. Exemple : Le dioxygène est un des gaz composant l' atmosphère terrestre.Série générale.Le dioxygène ou oxygène moléculaire est la forme de l'oxygène trouvé dans l'air.Balises :DioxygèneNO 2 À cet effet, la couche d’ozone sert de filtre contre les ultraviolets qui frappent la Terre.L'ozone est ainsi une variété allotropique de l'oxygène, mais bien moins stable que le dioxygène O 2, en lequel il tend naturellement à se décomposer. 4a-Donner les compositions atomiques des molécules de dioxygène et d’ozone. Expliquer l'origine de la composition de l'atmosphère primitive (doc.Critiques : 20 Mise à jour le 01/01/21. L'oxygène est également présent dans l'eau sous la forme de dioxygène. Cette combustion produit de l’eau et du dioxyde de carbone.Données thermiques. L’oxygène est un élément chimique de numéro atomique 8, ce qui signifie qu’il y a 8 protons dans son noyau. Point de fusion: -218. Correction : Ex 10 page 168 a.
Les atomes et les molécules
Balises :Formule ChimiqueLa MoléculeSymbole AtomiqueAtomsMoleculesFaisons brûler un morceau de fusain (constitué d'atomes de carbone, C) dans l'air. L'appellation « azote » sans autre précision est ambiguë parce que ce terme peut désigner l'élément azote (N) ou la molécule d'azote (N 2).Le dioxygène, communément nommé oxygène, est une substance constituée de molécules O2 (constituées chacune de deux atomes d'oxygène).En classe: séance 01 S1 => Consignes: A l'aide des documents fournis.
Oxygène — Wikipédia
L'ozone (de l'allemand Ozon, dérivé du grec ozô « exhaler une odeur »), ou trioxygène, est une substance de formule chimique O 3 : ses molécules sont triatomiques, formées de trois atomes d'oxygène. Mais un électron est environ 1000 fois plus léger : la masse des électrons est donc négligeable par rapport à celle des protons.Dioxygène : définition et explications - AquaPortailaquaportail.Principales utilisations du dioxygène.L'atome d'oxygène est très présent sur notre planète mais jamais seul, il est toujours associé à d'autres atomes au sein de molécules. C'est une molécule constituée par l'assemblage de deux atomes d'oxygène et a donc la formule O .
Ozone — Wikipédia
Sous forme d’oxy-acétylène, il est utilisé pour le soudage et le coupage des métaux.
Durée de l’épreuve : 1 h 00. Point d'ébulition: -182. Jusqu'en 420 av. Sa structure électronique est donc la suivante : (K) 2 (L) 8 (M) 18 (N) 32 (O) 18 (P) 2 soit 80 électrons répartis dans les différentes couches., les savants . Sa formule chimique est O2. Le carbone et le dioxygène semblent s'assembler . Ce sujet comporte 7 pages numérotées de la page 1/7 à la page 7/7. Il brûle vivement en produisant une forte lueur.20% de dioxygène; On peut aussi exprimer cette composition approchée sous forme de fraction, L’air est composé de: quatre cinquième de diazote ; un . Dès que le sujet vous est remis, assurez-vous qu’il est complet.Le dioxygène est composé de molécules qui résultent de l’association de deux atomes d’oxygène d’où le nom de dioxygène.Masse molaire : 32,00 g/mol.2 et 3) Déterminer puis comparer les états physiques de l'eau sur la .Le dioxyde d'azote est un composé chimique de formule NO2. On retiendra que l’air est constitué en volume d’environ 20 % de dioxygène et de 80 % de diazote, soit 1/5 de dioxygène et 4/5 de diazote.Résumons : Le méthane (ou le butane) réagit avec le dioxygène contenu dans l’air. Même au laboratoire, on ne s'adresse plus guère, pour la préparation du dioxygène, aux méthodes fondées sur la décomposition du chlorate ou du permanganate de potassium, de l'oxylithe (Na 2 O 2, K 2 O 4 ), etc.L'atome est le constituant fondamental de la matière, invisible à l'œil nu. préciser la composition du noyau de chacun des isotopes de l’oxygène.Structure atomique 79 . Car la composition atomique initiale est
L'air et sa composition
La composition de l'air : cours 5e (et 4e, 3e)
propane + dioxygène → dioxyde de carbone + eau b.
Dioxygène
Même au laboratoire, on ne s'adresse plus guère, pour la préparation du dioxygène, aux méthodes fondées sur la décomposition du .Elle est constituée de 4 atomes de carbone et de 10 atomes d’hydrogène.Les températures critiques du diazote N 2 (T c = −146,9 °C) et du dioxygène O 2 (T c = −118,4 °C) ne permettent pas la liquéfaction de l'air par simple compression.

L’O 3 absorbe considérablement en termes d’ultraviolets du spectre électromagnétique.Par exemple, l'oxygène est un constituant de l'eau (H 2 O, un seul atome d'oxygène), mais du dioxygène existe également dissous dans l'eau (ce qui permet la . Ainsi la masse de l’atome est concentrée dans le noyau. L'air est composé en volume de : 21 % de dioxygène ; 78 % de diazote ; 1 % d'autres gaz divers (argon, dioxyde de carbone, hydrogène, vapeur d'eau, ozone, etc.Vue d’ensemble
Dioxygène
Autour de l'oxygène, structure, dosage du dioxygène dissout, iodométrie concours Mines 03.

Température de solidification : –218,79°C. Il devient incandescent (il rougit en produisant une lueur). Loi des proportions multiples La loi des proportions multiples est une loi .
Le dioxyde de carbone
Le dioxygène est composé de 2 atomes d’oxygène : O 2.
Dioxygène
Lorsqu’il y a assez de dioxygène, la combustion est complète (flamme bleue).L'air est composé d'environ 20% de dioxygène et de 80% de diazote.








