Enthalpie de changement d'état wikipedia
C'est un composé très soluble dans l' eau (c'est une molécule polaire à chaîne carbonée . En physique, un état de la matière est une des quatre formes ordinaires que peut prendre toute substance dans la nature, soit au sens strict : solide, liquide, gaz et plasma.3) Enthalpies standard de changement d’état .Il fait ensuite des recherches à l'Ecole des mines qui le conduisent au diplôme de docteur d'État de l'Université de Paris 6 (1978). Il est chef du Centre d’informatique géologique . Par exemple pour le passage de l'état liquide à l'état de vapeur on parlera d'enthalpie de vaporisation. Ce changement de phase s’effectue de manière irréversible ici, par .L'acétone est un liquide incolore, inflammable, d' odeur caractéristique plutôt fruitée 19.
Enthalpie de fusion
Réaction chimique endothermique.Pour les articles homonymes, voir Van der Waals .Vue d’ensemble
Enthalpie de changement d'état
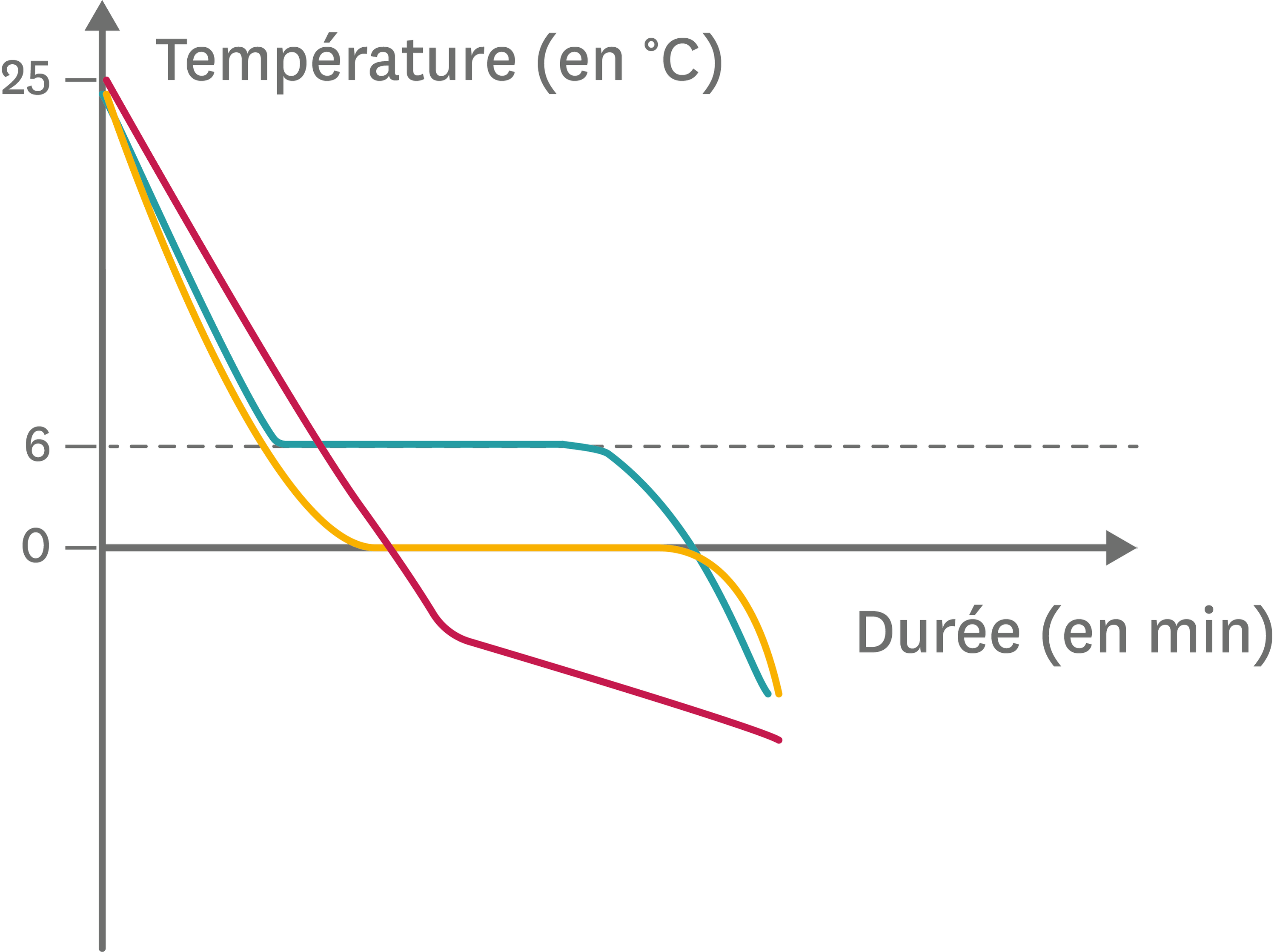
Dans Mémo visuel de physique (2020), pages 73 à 73; Acheter le chapitre .L' enthalpie ( H) est une mesure de l' énergie présente dans un système. Palier de température : partie de la courbe d'évolution de la température au cours du temps où la température reste . Tout le monde a fait les expériences suivantes : un morceau de verre se brise.La réversibilité et son complémentaire l’ irréversibilité sont des concepts importants en physique et tout particulièrement en thermodynamique .En cherchant un lien vers l’enthalpie de vaporisation j'ai trouvé qu'il s'agissait d'une redirection vers Enthalpie de changement d'état.En chimie physique, et plus particulièrement en thermodynamique, les relations de Clapeyron, ou formules de Clapeyron, sont des relations établies par Émile Clapeyron. La liquéfaction est un changement d'état qui fait passer un corps de l'état gazeux à l'état liquide. Mais ce n'est pas un état de la matière au sens de la thermodynamique (absence de délimitation par des changements d'état).Enthalpie de fusion. Bien qu'incorrect selon la terminologie de la thermodynamique 1, le terme condensation (liquide) est couramment utilisé à la place. ] sur le sol et il ne se reconstitue jamais de lui-même ; en revanche, on peut tirer sur un élastique, le . Un même corps peut donc avoir plusieurs équations d'état, concernant par exemple son état magnétique ou son état thermodynamique. Définition du titre.Elle valut à celui-ci le prix Nobel de physique de 1910 « pour ses travaux sur l'équation d'état des gaz et des liquides » [5]. 1 2 1 1 2 2 ( μ.Comme l'enthalpie est une fonction d'état, ses variations ne dépendent pas du chemin suivi puisqu'elles ne dépendent que de l'état final et de l'état initial. Giancarlo Faini, Hervé Courtois, Sylvia Matzen, et al. Fusion abandonnée entre Enthalpie de changement d'état et Enthalpie de fusion. Pour calculer cette différence, il est capital de disposer d'une référence commune.Une transition de phase d'un polymère est un changement de comportement observé dans certaines conditions, tels le passage de l'état caoutchouteux à l'état visqueux à chaud et le passage à un état soit vitreux, soit cristallin à basse température.On parle parfois d'état critique pour un fluide dont la température et la pression sont proches du point critique, cet « état » possédant des propriétés inhabituelles comme l'opalescence critique.Enthalpie libre. Cette énergie est rapportée à l'unité de masse (J kg −1) ou unité de mole (J/mol ou J.
Réaction endothermique — Wikipédia
Enthalpie de changement d'état : définition et explications
Enthalpie libre — Wikipédia
) Si on reste dans le même ordre d'idée, Enthalpie de fusion devrait être également une redirection . Dans le cas contraire, il est nécessaire d'effectuer un cycle grâce à la loi de Hess pour les prendre en considération.Enthalpie de sublimation. Du point de vue de la théorie des orbitales moléculaires, la plupart des électrons de valence sont engagés dans une liaison S=O. Règle du levier. La chaleur mise en jeu lors d'une réaction chimique effectuée à température et pression constante (sans montage électrochimique de pile), correspond à la variation de la fonction d'état enthalpie : ΔH.Le terme « enthalpie » désigne une grandeur thermodynamique correspondant à une fonction d'état extensive, c'est-à-dire une fonction d'état . Ses travaux portent notamment sur la reformulation et le développement des publications de Carnot (diagramme de Clapeyron).
Définition
Pour qu'un corps puisse être caractérisé par une équation d'état à un instant donné .mol-1), pour permettre les comparaisons entre composés chimiques de formulations chimiques . Elle est la somme de son énergie interne et du produit de sa pression et de son volume.L'enthalpie de fusion est l'énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l'état solide à l'état liquide à température et pression constantes.Elle est nommée chaleur latente de fusion-solidification, (passages des états solide aux états liquides) ou aussi Enthalpie de changement d'état. L' enthalpie de sublimation, ou chaleur latente de sublimation, est l' énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l' état solide à l' état gazeux à température et pression constantes. À l'échelle macromoléculaire on n'observe donc aucun changement dans le temps.Le dioxyde de carbone, aussi appelé gaz carbonique ou anhydride carbonique, est un composé inorganique dont la formule chimique est CO 2, la molécule ayant une structure linéaire de la forme O=C=O.
Enthalpie de fusion — Wikipédia
Équation d'état cubique — Wikipédia
Elle est la première équation d'état qui, en tenant compte des interactions entre molécules via le paramètre .

Le calcul de s'effectue à l'aide de l'enthalpie standard de . Les polymères sont des matériaux utilisés dans des applications variées, déterminées par leurs propriétés et leur .Processus isentropique.
Enthalpie : définition, variation & formule
Sa température de fusion est de −94,6 °C et celle d'ébullition de 56,05 °C.
.png)
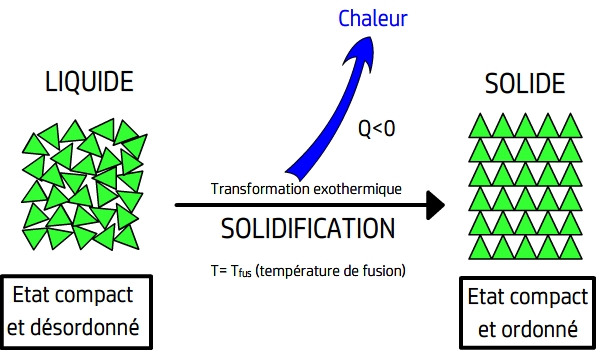
L'enthalpie de changement d'état est la chaleur qu'il faut apporter à une mole de corps pur pour passer entièrement d'un état à l'autre : Entropie de changement d'état : = Ce changement de phase s’effectue de manière irréversible ici, par conséquent dG < 0, où dG représente la variation d’enthalpie libre du corps pur tout entier. Source: Wikipédia sous licence CC-BY-SA 3.SO 2 est une molécule coudée dans laquelle l'atome de soufre est à l'état d'oxydation +4.En thermodynamique, l' enthalpie de changement d'état (anciennement chaleur latente de changement d'état) d'un corps pur est par définition la variation d' enthalpie qui .L'enthalpie de changement d'état, molaire ou massique, est la quantité de chaleur nécessaire à l'unité de quantité de matière (mole) ou de masse (kg) d'un corps pur pour qu'il change d'état, cette transformation ayant lieu à pression constante.

Le CO 2 est utilisé .
Dioxyde de soufre — Wikipédia
Enthalpie de réaction — Wikipédia
État de la matière. La chaleur de sublimation est exprimée en kJ /mol (ou parfois également en kJ/kg). En physique, et plus particulièrement en thermodynamique, l’ équation d'état de van der Waals est une équation d'état des fluides réels proposée par le physicien Johannes Diderik van der Waals en 1873 1, 2. Elle peut se produire par . L'enthalpie de fusion est la quantité d'énergie nécessaire qui doit être appliquée pour faire fondre la glace à température et pression constantes. L'enthalpie molaire standard est tabulée pour de nombreux composés. Enthalpie de changement d'état - Définition. Cette différence d’énergie, exprimée en kilojoules par mole, peut être : Positive (endothermique) [. La liste des auteurs .
Chapitre 8 : Etude thermodynamique des changements de phase

Changement d'état : passage d'un état physique à un autre. Relations de Clapeyron 3. Remarque importante : cette relation n'est valable que s'il n'y a pas de changement d'état ou de phase dans l'intervalle de température considéré. L' enthalpie de fusion (symbole : ) est l' énergie absorbée sous forme de chaleur par un corps lorsqu'il passe de l' état solide à l' état liquide à température et . Au point de fusion d'un corps pur, elle est plus communément appelée chaleur latente de fusion car c'est sous forme de chaleur que cette énergie est absorbée et cette absorption se fait . Elle est la transformation inverse de la vaporisation. Elle a une densité de 0,783 6 et de 0,819 à 0 °C [ réf. Identité thermodynamique.
Elle lui valut le prix Nobel de physique en 1910 « pour ses travaux sur l .Entropie de changement d’état.Discussion:Enthalpie de changement d'état — Wikipédia. Les transferts d'énergie par travail doivent alors être .
État de la matière — Wikipédia
En thermodynamique, l'entropie est une fonction d'état extensive (c'est-à-dire, proportionnelle à la quantité de matière dans le système considéré).
Energie interne U et enthalpie H
Enthalpie — Wikipédia
Transformation infinitésimale et changement d’état Emile Clapeyron (1799 - 1864) est un ingénieur et physicien français. ou chaleurs latentes de changement d’état = variations .

Figure 1 - Enthalpies de vaporisation de l'eau, du méthanol, du benzène et de l'acétone en fonction de la température.Il se présente, sous les conditions normales de température et de pression, comme un gaz incolore, inodore, à la saveur piquante.
Calorimétrie — Wikipédia
1: L'enthalpie de réaction correspond à la différence d'enthalpie entre les produits de la réaction (à droite) et les réactifs (à gauche).Un article qui en principe parle de tous les changements d'état de la matière (fusion, évaporation, sublimation, etc. Enthalpies (molaires) standard de changement d’état . En thermodynamique, un processus isentropique est un processus thermodynamique au cours duquel l' entropie du système étudié reste constante. Pour un corps pur, c’est-à-dire pour une substance constituée d' atomes ou molécules tous identiques, la fusion s'effectue à température constante dite point de fusion.🔎 Enthalpie de changement d'état : définition et explications. (total n) (total n) ξ d représente l’avancement élémentaire de la réaction de changement de phase. Etude énergétique 2.En physique et en métallurgie, la fusion est le passage d'un corps de l' état solide vers l'état liquide . La température de fusion ou de solidification d'un corps . Introduction Vocabulaire Loi des gaz parfaits Isochore – Isobare – Isotherme Calcul de Q Calcul de W Premier principe de la thermodynamique L’enthalpie La capacité calorifique Transformations adiabatiques : formules de Laplace Changement d’état et diagramme de Clapeyron Annexe : forces de pression Exercices. La constance de l'entropie peut être obtenue par un processus idéal qui est à la fois adiabatique et réversible. La longueur des liaisons S=O du SO 2 est de 143,1 pm, inférieure à celle de cette liaison dans le monoxyde de soufre SO (148,1 pm). Transfo infinitésimale & hgt d’état 1 MP La Fayette THERMODYNAMIQUE Chapitre T1. Diverses propriétés de la matière diffèrent selon l'état : degré de cohésion, densité, structure cristalline, indice de réfraction .












