Ions fe2 et br
Les dosages redox | Cairn Sciences. La détermination de la molarité d’une solution d’oxydant, par exemple, peut être réalisée par titrage avec un réducteur. Combien l'ion FE2+ contient-il d’électrons ?? Réponse. This means we have to go to a least common multiple . Who are the experts? Experts have been vetted by Chegg as specialists in this subject. Déterminer les potentiels des deux électrodes. There are 2 steps to solve this one. En déduire la concentration en ions Ag+ dans la seconde demi-pile et calculer le produit de solubilité du chlorure d’argent Ks. Le rayon ionique caractérise, comme tout rayon, le volume . Le précipité. We need three F − ions to balance the charge on the Al 3 + ion, so the proper ionic formula is AlF 3. Faire un schéma de la pile.
Test d'identification des ions fer II
With Al 3 + and O 2−, note that neither charge is a perfect multiple of the other.L'équation de réaction, dite équation d'oxydréduction s'écrit: Cu 2+ + Fe → Cu + Fe 2+.

Le bromure de fer (III), également appelé bromure ferrique, est un sel de fer de formule chimique FeBr 3.La situation pratique précédente serait une lame de platine plongeant dans une solution d’ions Fe3+. Déterminez les oxydants et les réducteurs à partir des demi-équations électroniques : Fe3+ + e- = Fe2+.Test d’identification des ions fer II. Attention : Au-delà de son domaine d’existence, un solide n’existe pas.COUPLE RÉDOXEQUATION RÉDOXE° EN VAg + /AgAg + + e - Ag0,7996Al 3+ /AlAl 3+ + 3e - Al-1,662Au + /AuAu + + e - Au1,692Br 2 /Br -Br 2 + 2e - 2Br -1,087Voir les 31 lignes sur www. bonjour, L'ion FE2+ . Solutions aqueuse contenant des ions fer II.1) Identifier l'oxydant et le réducteur de la réaction. Pour écrire le bilan (l'oxydant du couple (1) réagit sur le réducteur du couple (2), on renverse la deuxième demi équation et on fait la somme des deux demi-équations en faisant attention . Diagramme de Pourbaix d'une solution aqueuse de fer.
Analyse qualitative des ions
Le ferrocyanure de potassium | Cairn Sciences.Critiques : 33Bromure de fer (III) Unités du SI et CNTP, sauf indication contraire.Utilisation biochimique.
Fascicule d’exercices corrigés d’oxydoréduction
Cu(s) + Br 2(aq) = Cu2+(aq) + 2 Br-(aq) b.
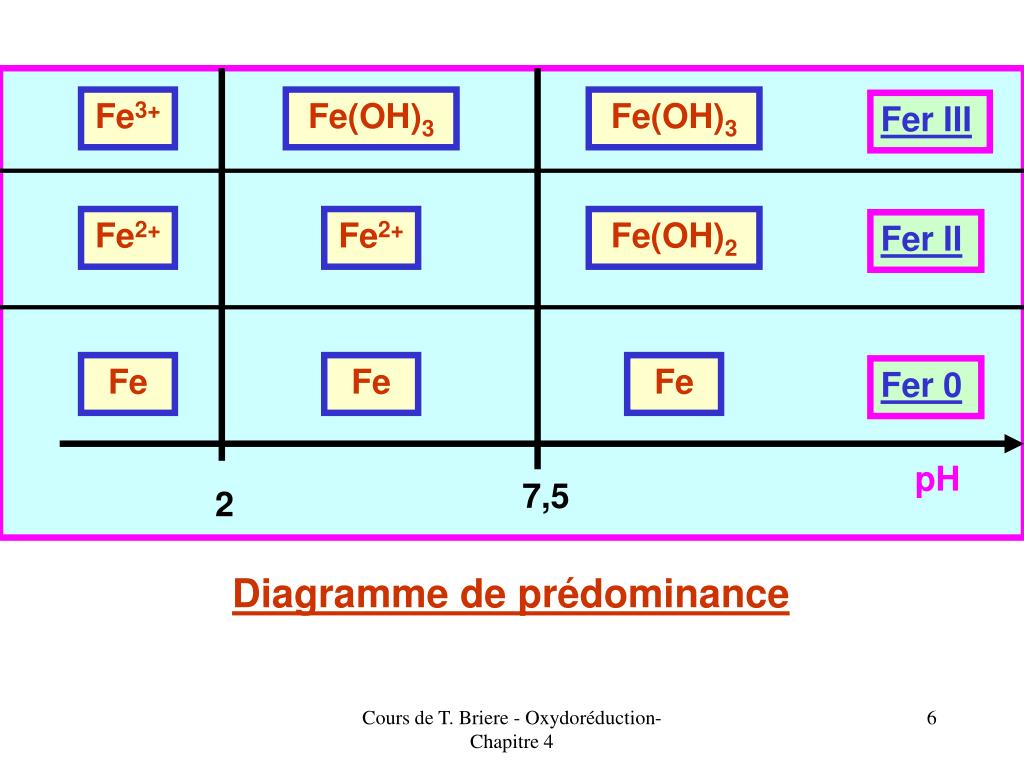
Diagramme potentiel-pH du fer
Le but de l'exercice est de comparer deux méthodes possibles pour réaliser la séparation des ions Cu 2+ (aq) des ions Fe 3+ (aq) présents dans une même solution.

Mesuré à partir de la distance entres cations et anions d'un cristal ionique. À partir de ce minerai, on prépare une solution aqueuse contenant des ions cuivre II (Cu 2+ (aq)) et des ions fer III (Fe 3+ (aq)). 100 % (5 ratings) Step 1. Etude des équilibres de précipitation : ♦ Fer (+II) → Fe(OH)2 ↓ [H ] d'oùlog[Fe ] 2pH 12. Couples rédox, équation rédox et potentiels . Show transcribed image text.Critiques : 20 Fe2+ (aq) Fe3+ (aq) + e- 3 - Couples oxydant/réducteur (couples . Les ions Fe2+ d'une solution de sel de Mohr sont stabilisés par la présence des ions ammonium et sulfate. On trace ici le diagramme potentiel pH du fer pour c=10-2mole.5 Charge et formule de quelques ions Mobiliser des connaissances et raisonner a.9 K K [Fe ] [H ] K Fe(OH) Fe 2OH K 10 [Fe ] [OH ] .Le sel de Mohr, (NH₂)₂Fe (SO)2, 6H₂O, comme le sulfate de fer (II), libère des ions fer (II) en solution. Dosages d’oxydoréduction. Cu(s) ! = Cu2+(aq) + 2 ! Br 2(aq) + 2 !! = 2 Br-(aq). 2) Etablir les demi-équations électroniques associées. Données : Couples redox mis en jeu .Il est soluble dans l’eau et dans certains solvants organiques, produisant une solution jaune-verte en raison de la présence d’ions Fe 2+. report flag outlined.La plupart des ions métalliques, comme les ions Fe2+ ou Pb2+, forment avec certains anions des édifices moléculaires solubles dans l’eau, appelés complexes.
Camerecole
L'oxyde de fer(II), également appelé oxyde ferreux, est un composé chimique de formule brute FeO.Le bromure de fer(II) est un composé inorganique de formule chimique FeBr 2. 28 personnes ont trouvé cela utile.
Ion ferreux — Wikipédia
Une solution aqueuse de bromure de fer Il contient des ions Fe2+ et des ions bromure.

Vue d’ensemble
Couples d'oxydoréduction / Demi-équations associées
En chimie, l' ion ferrique (Fe 3+) est l' ion trivalent du fer ( état .
On donne les couples mis en jeu : Ag+/Ag et Cu2+/Cu.Elle consiste en un transfère d'un ou plusieurs électron (s) du réducteur de l'un des couples à l'oxydant de l'autre couple. Espèces conjuguées On donne les demi-équations . Ecrivez la formule chimique du composé ionique formé par . En revanche, les ions continuent d’exister au-delà de leur domaine La concentration en ions Fe2+ de la solution est 0,25 mol-L-1.L’eau est à la fois un produit dans l’étape 1 et un réactif dans l’étape 2, elle n’apparaît donc pas dans le bilan final de la transformation (on pourra voir en classe de terminale que son rôle est celui d’un catalyseur). Définir un oxydant et un réducteur.
Bromure de fer(III) — Wikipédia
L'atome de fer a 26 électrons.
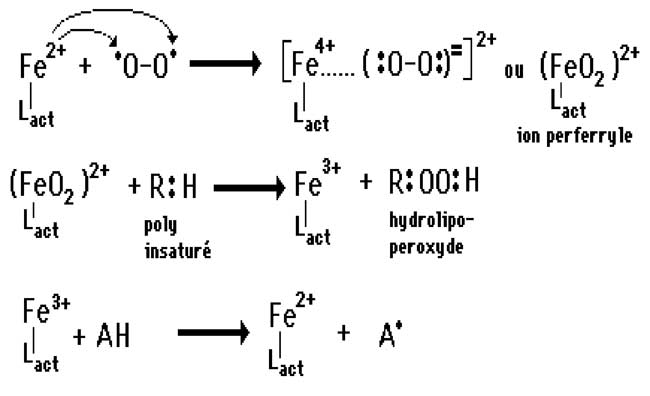
En réalité, deux facteurs limitent cette augmentation théorique : .
Les Transformations Chimiques
L'élément fer en solution se présente sous forme de Fe2+ et Fe3+. La réaction chimique C2+ est une réaction d'oxydoréduction entre le .On envisage le dosage potentiométrique des ions fer (II) par des ions cérium (IV) (ions ferreux et ions cériques) : écrire la réaction de dosage. On dosera l'élément fer dans un vin blanc.
Table des potentiels standards
C'est un précurseur commun à d'autres composés du fer en laboratoire de recherche, mais .Au3* (aq) + 3 Fe2+ (aq) Au (s) + 3 Fe3+ (aq).

Par ailleurs, un surdosage en fer est également nocif pour la santé. Expert-verified. Cette demi-équation indique que l'ion cuivre se transforme en atome de cuivre par gain de deux électrons.Réaction entre les ions argent (I) et le plomb. Par conséquent il n'apparaît aucun électron dans l'équation de la réaction. Les ions ferreux (Fe2+) et ferrique (Fe3+) donnent des complexes octaédriques avec les ions cyanure . Cependant, la couleur d'un ion peut être masquée par une . Propriétés Propriétés chimiques Rayon ionique.I : REACTIONS D'OXYDOREDUCTION.
Une solution aqueuse de bromure de fer Il contient des ions Fe2
le pH (et la précipitation éventuelle des phases). Pour les articles homonymes, voir Ferrique . Quel est le nombre d'électrons de l'atome de fer ? Solution. La réalisation du test de . Elle est laissée à l'air libre sur la paillasse d'un laboratoire. Dans les toutes premières années de la vie d'un enfant, les besoins en fer alimentaire sont très importants, sous peine de carence alimentaire ( anémie ferriprive ).Dosages d’oxydoréduction Notion d’oxydoréduction en solution aqueuse. • En donnant des électrons, un réducteur subit une oxydation. Écris la formule des ions formés lorsque : - l'atome d'hydrogène (H) perd un électron; - l'atome . Rayon de la forme ionique principale (donnée par sont degré d'oxydation principal). Pour E = 1 V et pH = 10, on se trouve dans le domaine d’existence de Fe(OH)3(s). A n S S: − 2. hydrure : Al 3+ ion . Le fer est un élément indispensable au corps humain. Recopie et complète le tableau suivant.Le composé anhydre est un solide paramagnétique de couleur jaune ou brunâtre.
les ions Cl - sont présents au départ et à l'arrivée, ils ne prennent pas part à la réaction qui fait .Le fer y est à son état d'oxydation +2. La réaction de précipitation. Formule moléculaire : FeBr 2. aluminium : F- fluorure : Ag + argent : Cl- chlorure : . On oxyde donc au préalable le Fe2+ (éventuellement présent **) en Fe3+, par le peroxyde d'hydrogène .NO; (aq)/NO (g) et Fe3+ (aq)/Fe2+ (aq) 2.Test des ions: - Pour détecter certains ions en solution aqueuse on réalise des tests. Il s'agit d'un oxyde de fer se présentant au laboratoire sous la forme d'une poudre noire, sa forme minérale étant la wustite.Critiques : 27
Première S Ecole Alsacienne Ajuster une équation d'oxydo-réduction
1 Définitions Le dosage est une opération qui consiste à déterminer la concentration d’une solution à partir d’une autre solution de concentration connue. Le noyau de l'atome de Fer contient 26 protons. Recopier les équations, et, sur chacune d'elles, entourer en noir le réactif qui a le rôle d'oxydant, et en bleu le réactif qui a le rôle de réducteur. Certains ions confèrent aux solutions aqueuse une coloration caractéristique. Le rayon est exprimé en pm (pico mètre = 10 -12 m).9 Give the electron configurations for the following + ions: Fe2+, Al3+, Cu, Ba2+, Br, and 02-. En solution aqueuse, certains corps sont ionisés, on écrit : 2H + + 2Cl - + Zn ® Zn 2+ + 2Cl - + H 2. Tous les électrons cédés par le réducteur du premier couple sont captés par l'oxydant du deuxième couple. On commence par écrire les deux demi-équations : Ag+ (aq) + e- = Ag. Écrire pour chacune des réactions d'oxydoréduction les couples oxydant/réducteur qui interviennent. Les ions chlorures n’interviennent dans aucun un couple redox donc dans le chlorure ferrique seul les ions fer III réagissent. La transformation de chaque élément (cuivre et fer) peut être décrite séparément par une demi-équation de réaction: Cu 2+ + 2e → Cu.3 - Couples oxydant/réducteur (couples rédox) Un couple Oxydant/Réducteur est constitué d’un oxydant et d’un réducteur, reliés par la demi-équation électronique: Oxydant + n.Ressources Physique-Chimie 1ere s Les Transformations Chimiques. Par exemple, dans le cas du dosage des ions Fe2+ par les ions Ce4+, les deux couples . Faisons agir l'acide chlorhydrique sur du zinc.Liste des principaux ions: Ions MONOatomiques à charge fixe (M + et X-) Ion X-Nom : Ion M+.4,3/5(18)
REACTIONS CHIMIQUES
NO; (aq) + 4 H + (aq) + 3 NO (g) + 2 H20 (C) Fe2+ (aq) 3 Fe3+ (aq) + e- NO; (aq) +4 + 3 NO (g) + 2 + 3 (aq) L'ion nitrate dans un . - Certains ions positifs et négatifs sont dits incompatibles et forment ensemble un précipité (solide) qui apparaît en solution si on y .fr est un service gratuit d'aide aux devoirs, du groupe Brainly. A quoi sert-il.L'ion fer (II) Fe2+ (aq) est un réducteur car il est capable de donner un électron en donnant l’ion fer (III) Fe3+ (aq). Les ions fer III sont les oxydants du .Le minerai de cuivre contient des impuretés en particulier du fer. Ecrivez la formule chimique du composé ionique formé par chaque paire d’ions.On utilise pour cela la loi de BEER-LAMBERT : l'absorbance est proportionnelle à la concentration de la substance colorée. Quelle est la quantité d’électricité échangée pour un avancement de 1 .
Dosage des ions Fe2+ 3+et Fe dans un vin blanc
C'est un portail d'entraide, de coopération, d'échange d'idées. La première électrode est le pôle positif de cette pile, et la force électromotrice de la pile est E=0.






/GettyImages-680746470-bbd54679e8c64f969d54357e94002efb.jpg)
