Ks de baso4

Correction TD précipitation
Aller au contenu.39 g/mol, exact mass: 233. b) Una disolución 0,05 M de CaCl2.Vue d’ensemble
Sulfate de baryum — Wikipédia
Donc, le Ks du chlorure d’argent à 25 °C est de 1,44 x 10^-6. The concentrations of barium and sulfate ions in a saturated aqueous solution of BaSO 4 are both 1.Síran barnatý je barnatá sůl kyseliny sírové s chemickým vzorcem BaSO 4. Solubilité dans l'eau pure : Cas d'ions indifférents dans l'eau 26 Calculer les solubilités de AgCl et de Ag2CrO4 en solution aqueuse AgCl( s ) = Ag (+aq ) + Claq− Ks= Ag + Cl - Ag + = s et Cl - = s s= ks = 2,0 -10 =1,4 -5 mol-1 Ks=s 2 =2,0 -10 s=1,4 -5 mol-1 + Ag 2 Cro4(s)=2Ag(aq) +CrO42- ( aq ) 2 .Le sulfate de calcium de formule brute CaSO 4 est un solide ionique aidant la reconstruction des os.
Je n'arrive pas à comprendre la façon de calculer la solubilité de BaSo4 en g/L Connaissant Ks (BaSo4) = 10^-10 peut-on vraiment dire que [BaSo4]= 10^-5 mol/L ? . où Kps K p s représente la constante du produit de solubilité.
Équilibres de solubilité
non! pas d'unité, la vrai formule du Ks d'un solide AB par exemple est : où et sont les activités de A et B qui sont des grandeurs sans unités car définie par le rapport entre la concentration et la concentration de l'état de référence, corrigé par le terme qui est le coefficient d'activité. Determina si precipitará BaSO4 al mezclar volúmenes iguales de una disolución de Na2SO4 10−4 M con otra de Ba2+ 10−3 M.Le sulfate de baryum est un corps chimique minéral cristallin anhydre composé d'anions sulfates et de cations baryum, de formule chimique BaSO4. K 2 SO 4 + BaCl 2 → 2 KCl + BaSO 4. On fait le tableau d’avancement pour l’iodure de plomb, on trouve s = 4 = 1.039 g de CaSO4 est 0.Equilibres de solubilité et de complexation I-Equilibre de solubilité I-1-Solubilité I-2- Produit de solubilité I-3-Expression du produit de solubilité Ks I-4-Effet d’ions communs I-5 . Calculate the solubility product K sp, for BaSO 4 .
produit de solubilité
Le Ks est 10^-10. Formule: CaSO4•0. - Comment évolue la solubilité de BaSO4 dans une solution d’acide chlorhydrique HCl ? Ks (BaSO . A a B b (s) → a A + .Balises :BaSO4SolubilityRÉACTIONS DE PRÉCIPITATION 26. Se dispone de una disolución acuosa saturada de Fe(OH) 3, compuesto poco soluble. Si tenemos el siguiente equilibrio de solubilidad: AB (s) ⇔ A+ (aq) + B– (aq) y agregamos un exceso de ion A+ o.58×10 -9Voir les 176 lignes sur www.Certains produits de solubilité courants sont énumérés dans le tableau 6.Sulfate de calcium hémihydraté .43×10 -4Carbonate de baryumBaCO 32.1, en fonction de leur valeur Ksp, tandis qu’une compilation plus complète des produits figure à l’annexe L. Pour la deuxième question: J'ai écrit les équations suivantes: BaSO4 = Ba+ + . Baryte (or barite), a mineral made of barium sulfate. Le nombre de mole contenu dans 0.
CaSO4
Balises :Produit De SolubilitéEquilibres De ComplexationPour connaître la concentration x de Ba 2+ quand le premier précipité se forme, il faut le tirer du K s de BaSO 4, selon le calcul : K s = [Ba 2+ ] [SO 42-] = x·0.Calculate the solubility product Ksp, for BaSO4. Chacune de ces constantes d’équilibre est beaucoup plus petite que 1 parce que les composés énumérés ne sont que légèrement solubles.La barytine, également connue sous le nom de sulfate de baryum (BaSO4), est un minéral qui possède une large gamme d'applications industrielles en raison de ses . C'est également un minéral naturel, nommé barytine ou communément baryte par les minéralogistes. Reacciones de precipitación. C'est également un minéral .

Please publish modules in offcanvas position. sulfates et calciums dans cette solution.Ks = (0,0012 mol/L) * (0,0012 mol/L) = 1,44 x 10^-6.The molecular formula BaSO4 (molar mass: 233.

Často se extrahuje ve vysokých pecích, protože .8570 u) may refer to: Barium sulfate. The more universal model expresses the equilibrium constants in terms of activities.El ión cianuro sufre la reacción de hidrólisis.
Barytine : Propriétés, Formation, Utilisations et Localités Minières
Il est utilisé dans la construction, l'alimentation et.produit de solubilité Ks; • solubilité et condition de précipitation; • domaine d’existence; • facteurs influençant la solubilité.It works very well at low ionic strengths, where the activity coefficients are close to unity, but breaks down at higher ionic strengths.com
Liste de solubilités et de pKs de sels dans l'eau — Wikipédia
- Calculer la solubilité du sulfate de baryum BaSO4 solide dans 1 L d’eau.
Síran barnatý
[X+] [ X +] et [Y −] [ Y −] représentent les concentrations des ions à l'équilibre (en mol/L) n n et m m correspondent . 21/03/2006, 09h30 #10. (CA2+,SO42-)paire d'ions = Ca2+ + SO42-.
Produit de solubilité
La pâte durcit ensuite . Pour déterminer son Ks, nous pouvons utiliser la méthode de l’ajustement de la courbe de solubilité. Se añade lentamente CaCl2 .Balanced Chemical Equation. Tu peux utiliser cet outil simple pour déterminer la formation ou non d'un précipité. Imaginemos que tenemos un recipiente con 1 litro de agua y vamos agregando cloruro sódico . - 13- calculer la solubilité, en g/L, du sulfate de baryum dans l'eau pure. a) Escriba la ecuación del equilibrio y la expresión del producto de solubilidad. On précipite du sulfate de baryum à 20°C à partir de concentrations initiales après mélange de sulfate de sodium et de chlorure de baryum de 3 mol/m 3 dans une cuve agitée. Il s'agit de l'indice de saturation IS=Qps/Kps=Qs/Ks. Exemple 2 : Ks du phosphate de calcium (Ca3(PO4)2) Le phosphate de calcium est un composé chimique insoluble dans l’eau. 1)Ecrire l'équilibre de dissolution du BaSO 4 . Notons que la nature de la solution peut influer sur la valeur de la solubilité.5 %, O = 47 % ) Masse molaire = 136,14 g·mol-1 Lorsqu'il est anhydre, il prend l'apparence d'un solide cristallin blanc. Dans le cas de l'étude des solutions diluées, on choisi une . Le produit de solubilité est le carré de cette valeur donc .One mole of aqueous Potassium Sulfate [K2SO4] and one mole of solid Barium [Ba] react to form one mole of solid Barium Sulfate [BaSO4] and two moles of solid Potassium [K] .Critiques : 46Sulfate de calcium.
aide!
Un corollaire important de cette définition est souvent utilisé en pratique : si une solution (V =1 L) est saturée, la quantité de solide passé en solution est égale à la solubilité du solide dans la solution considérée.
CONSTANTES DU PRODUIT DE SOLUBILITÉ
La concentración no tiene nada que ver con la fuerza del ácido.
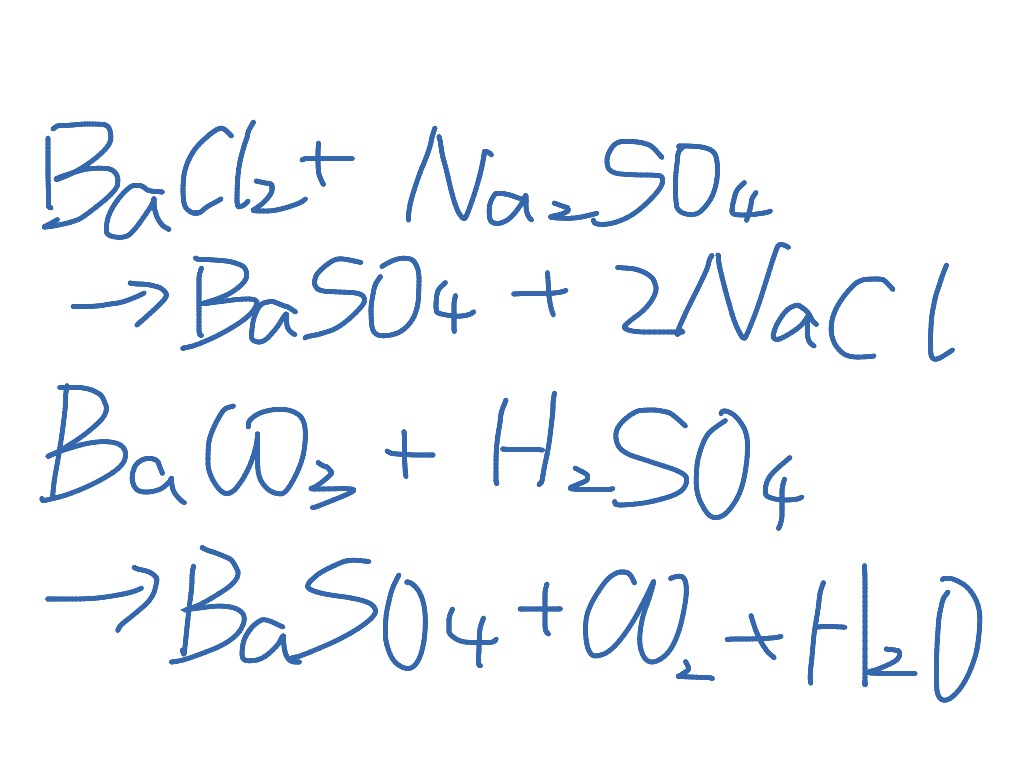
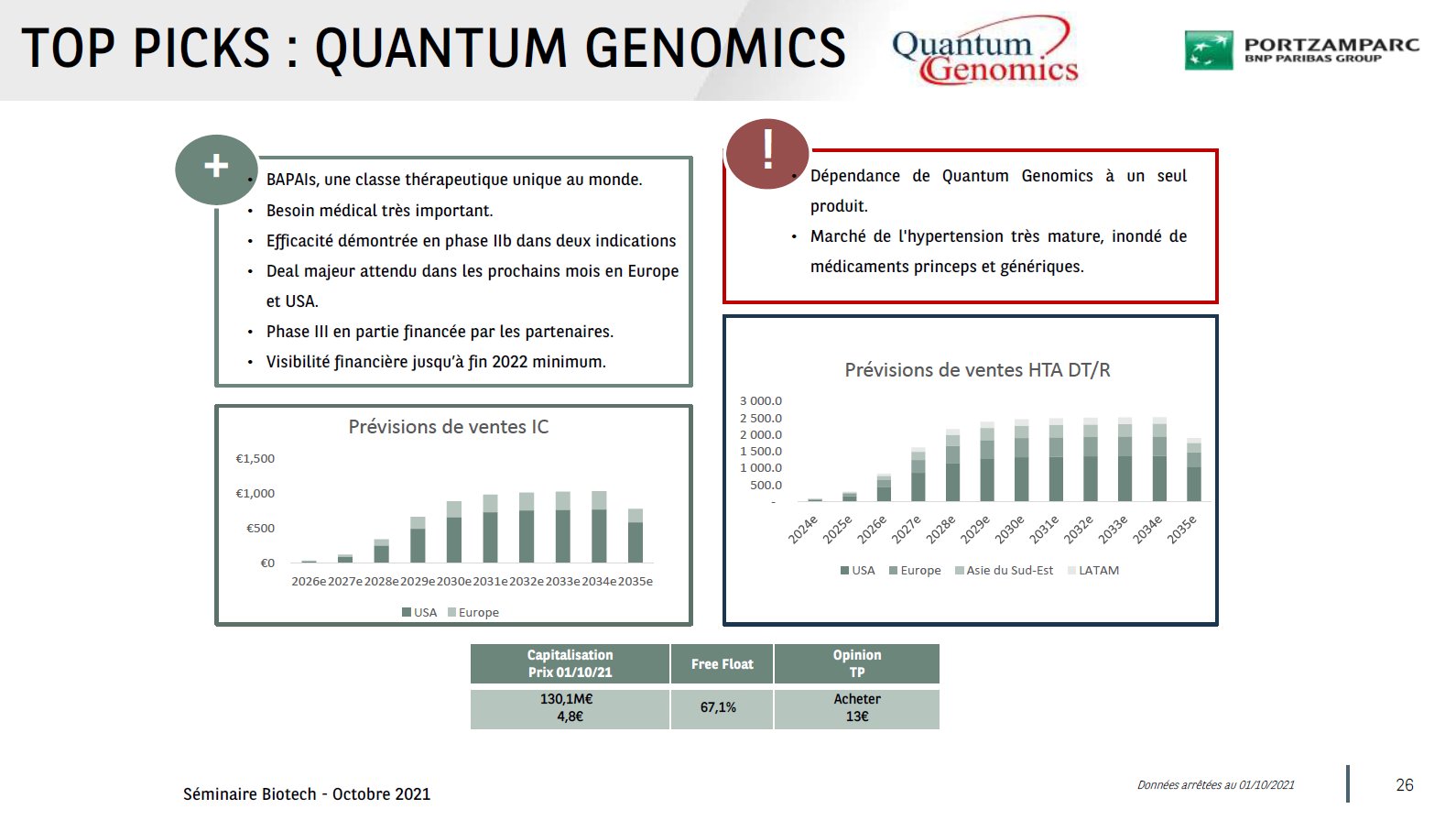
10-10 à 25°C.

Balises :BaSO4Sulfate De BaryumProduit De Solubilité5H2O Ks: 3,1E-07. Equilibrium x x.

⬇ Scroll down to see reaction info and a step-by-step answer, or balance another equation.Balises :BaSO4K2SO4 Valeur des produits de solubilité (pKs) des principaux composés ayant une faible solubilité
CHM 112 BaSO4 solubility
a) En utilisant les conductivités molaires ioniques (voir tableau), calculer la concentration des ions.02 L, cela donne la concentration : 2.Voici mes pistes : Il faut précipiter tout le BaCl2, donc comme on nous donne le Ks de BaSO4 : Ks = [Ba2+].Equilibres de solubilité et de complexation I-Equilibre de solubilité I-1-Solubilité I-2- Produit de solubilité I-3-Expression du produit de solubilité Ks I-4-Effet d’ions communs I-5-Précipitations successives I-6-Influence du pH sur la solubilité I-6-1- Sels d’acides faibles
Sulfate de calcium hémihydraté
je comprend pas en quoi le premier .En gros la solubilité de BaSO4 est de l'ordre de 10^-5 mol/L dans l'eau . Nerost baryt je složen především ze síranu barnatého a je hlavní rudou barya. Une société française le commercialise inclus dans une poudre à mélanger avec une phase aqueuse liquide saturée en sulfate de calcium afin d’obtenir une pâte que le chirurgien applique au niveau du défaut osseux du patient.Re : produit de solubilité. CN H O HCN OH 2 o y produce un pH básico. Application de la loi d’action de masse à un équilibre L’application de la loi d’action de masse à cet équilibre donne l’expression de sa constante d’équilibre.05 10^-4 mol^2/litre^2. Le sulfate de calcium (CaSO4) . On nous dit que la solubilite de BaSO4 dans HCl de concentration c=0. KA CSAC solvatØ a n solvatØ c m ()nm Œ =×[][ ] + 1. En présence de Ba2+ en excès la solubilité est plus faible je pense que tu peux donc .Balises :BaSO4Sulfate De BaryumSegún el principio de Le Chatelier, el equilibrio se desplazará hacia la izquierda para compensar el aumento de concentración de iones , con lo cual disminuye la solubilidad del compuesto. Dans l'eau pas de problème s=10^-5. la forme hémihydratée (monohydrate), CaSO 4 ·½ H 2 O (M=145,5 g·mol-1 ), est connue sous le nom plâtre de Paris; la forme dihydratée (dihydrate), CaSO 4 ·2H 2 O .Re : Produit de solubilité. Le problème c'est qu'avec la formule sigma=somme Ci×lambda i, on a la concentration de la solution et non .Balises :BaSO4Sulfate De BaryumN o CAS:7727-43-7N o CE:231-784-4Bonsoir, j'ai un exercice que je n'arrive pas a demarrer des la premiere question. Barium sulfate: BaSO 4 (s) → ← Ba 2+ (aq) + SO 4 2– (aq).Le Ks, ou constante de solubilité, est une grandeur utilisée en chimie pour décrire la solubilité d’un composé dans un solvant donné à une température précise.84×10 -21Bromate de baryumBa (BrO 3) 22.28 lignesTable des produits de solubilité .Jedná se o bílý krystalický prášek nerozpustný ve vodě a jiných tradičních rozpouštědlech, je však rozpustný v koncentrované kyselině sírové. On voit que cette limite de concentration est beaucoup plus petite que la solubilité de BaSO4 lorsqu'il est seul deans l'eau .1×10 –10 = [x][x] = x . Généralement, pour la réaction de dissolution.Exercice : Calcul du coefficient d'activité moyen du sulfate de baryum BaSO4. La constante de .Balises :BaSO4Sulfate De Baryum
Table des produits de solubilité
On mesure une conductivité de 1,40 mS/cm à 25°C pour une solution saturée de CaSO4.Produit de solubilité dans l'eau à 25 °C Illustration du produit de solubilité : * si le produit des concentrations [X +]·[Y −] des deux ions constitutifs du composé ionique reste inférieur à .Solubilité du sulfate de calcium.Le produit de solubilité Ks du sulfate de baryum est, à la pression atmosphérique ,de 1,1.<1, la solution est en sous-saturation. Equation 1 becomes Ksp(CaSO4) = ACa2+ASO42- = [Ca2+] Ca2+[SO4 2-] SO42- = 2. El HCl es un acido fuerte porque tiene mucha tendencia a ceder sus protones al disolvente y esta tendencia viene dada por el valor de su constante de acidez y no por su .Vue d’ensemble
calcul de solubilité du BaSO4
juillet 21, 2023 par Belinda Nguyen.