Loi de beer lambert absorbance

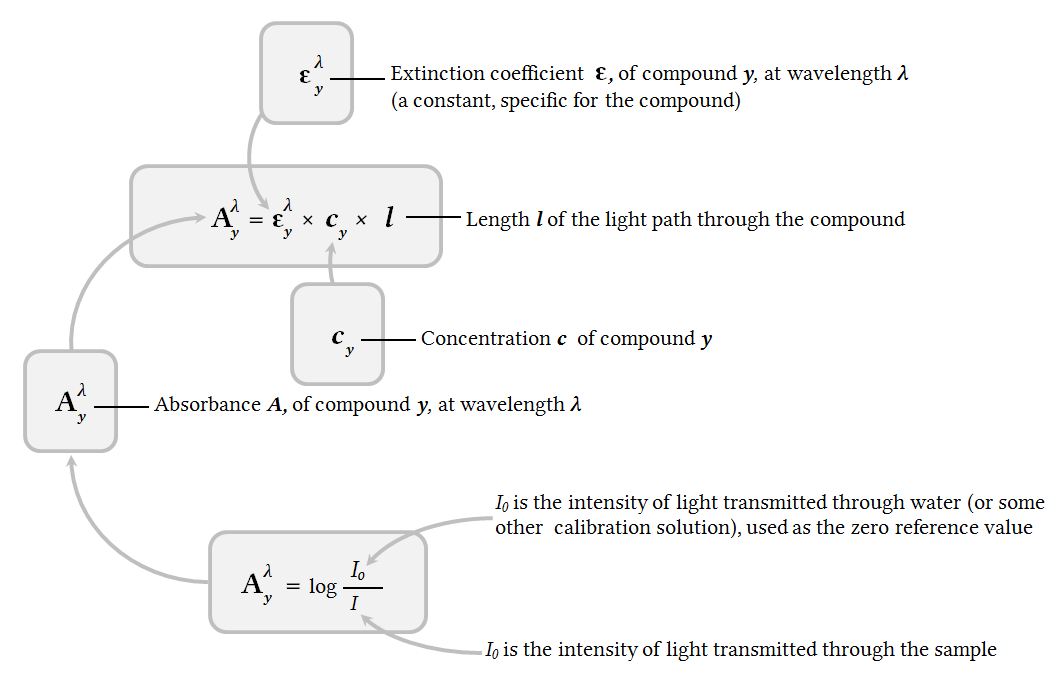
Couleur d’une espèce en solution. Attention : il y a un décalage de 0,5 mmol . L'épaisseur \(\ell\) de la cuve: plus cette épaisseur est importante et plus l'absorbance est grande. So it's proportional to the path length times the concentration.Cours : Absorbance et loi de Beer-Lambert PDF DOC. Elle suit la loi de Beer Lambert : Aλ = ε l c avec c en mol.La loi de Beer-Lambert permet d'associer l'absorbance d'une solution à sa concentration. Citer les domaines de validité de ces relations. Ø A λ: l’absorbance de la solution à la longueur d’onde λ Ø ε λ: le coefficient d’extinction molaire de l’espèce chimique en L.L’absorbance A est une grandeur qui mesure l’absorption de la lumière par une solution colorée, elle dépend de la concentration de la solution. On étudie au spectrophotomètre une solution de tartrazine.Loi de Beer-Lambert Quels sont les paramètres qui influent sur la valeur de l'absorbance ? LIEN vers le simulateur en ligne.Loi de Beer-Lambert Pour une longueur d'onde \lambda donnée, l'absorbance A_{\lambda} d'une espèce chimique en solution diluée est proportionnelle à la concentration c en quantité de matière de cette .
SPECTROPHOTOMÉTRIE OPTIQUE
La loi de Beer-Lambert établit une proportionnalité entre la concentration d'une .
Tout savoir sur la loi de Beer-Lamber en spectrophotométrie
(2)) (3) 4 Loi de Beer-Lambert Faites défiler pour voir la suite.
Déterminer une concentration à partir de la loi de Beer-Lambert
La relation entre la couleur d’une solution et sa composition chimique est aussi expliquée, et .Mots clés : Absorbance, Loi de Beer-Lambert, échelle de teintes, dosage par étalonnage.Ainsi, on obtient l'absorbance spécifique : absorbance qu'aurait une solution de produit de concentration 1% (1g/100mL) examinée sous une épaisseur de 1cm à une longueur d'onde donnée.© 2023 Google LLC.La formule de la loi de Lambert-Beer définit mathématiquement la relation entre la quantité de lumière absorbée et la concentration de soluté dans la . Cours en ligne : S’inscrire – Accéder Stage de révision du Bac. Spectre de bandes. Dosage spectrophotométrique d’un additif alimentaire le bleu patenté V 1ère E3C : spécialité physique chimie Calculatrice autorisée Physique. C’est une grandeur positive, sans unité, sa valeur est d’autant plus grande .La loi de Beer-Lambert, aussi connue comme la loi de Beer-Lambert-Bouguer et chez les francophones parfois même simplement comme la loi de Bouguer, est une relation empirique reliant l'absorption de la lumière aux propriétés des milieux dans lesquels elle passe.
Intensité des bandes d’absorption
Comment justifier la loi de Beer-lambert? La meilleure méthode consiste à . bonne chance 04/11/2005, 12h35 #7 invite4c7a167b. Dosage spectrophotométrique ou dosage par étalonnage. Dans les mêmes conditions de mesure que celle de la gamme étalon, une solution S de diiode a une absorbance A S = 1,25. I –L’absorbance 1/ La lumière La lumière est une onde électromagnétique : elle a la capacité de se propager dans le vide. ε est le coefficient d’extinction molaire qui dépend de la nature de l’espèce chimique et de la longueur d .
Absorbance et loi de Beer-Lambert
Préambule : Ce TP est le premier d’une trilogie sur le diiode.La loi de Beer-Lambert. La loi de Beer-Lambert est valable également dans le domaine infrarouge.Mesure Nom de la loi Formule Analyse de courbe Unités Absorbance Loi de Beer-Lambert $ A $=k×c ou -A $=ε $×l×c A $=f(c) est une droite passant par l’origine : A et c sont proportionnels. Lorsque de la lumière blanche traverse une .
Réaliser le dosage d'une solution colorée par étalonnage
L-1, l en cm et ε en L.

Absorbance d'une solution.L'absorption de la lumière est décrite par la loi de Beer-Lambert : I t /I 0 = 10 ε Cl, plus généralement exprimée sous la forme du rapport log (I 0 /I t) = A = DO = εCl, communément appelé absorbance (A) ou densité optique DO, avec C, la concentration de l'espèce absorbante, exprimée en moles par litre (M.
Loi BEER-LAMBERT : absorbance et concentration
Loi de Beer-Lambert.La loi de Beer-Lambert donne la relation entre l’absorbance A et la concentration C d’une solution colorée.Critiques : 97L-1; On peux également utiliser la relation entre .
La loi de Beer-Lambert
le coefficient d’extinction molaire en L·mol –1 ·cm –1 ;
À travers la matière
Détermination du protocole
Spectrophotométrie — Wikipédia
Pour une longueur d'onde donnée, l'absorbance d'un mélange est la somme des absorbances de chacune des molécules.
Beer-Lambert Dosage par étalonnage
La nature de la solution (espèce dissoute).Retrouvez TOUTES les vidéos de Physique-Chimie sur notre site https://www.
L'Absorbance
Selon la loi de Beer-Lambert, l’absorbance d’une solution est proportionnelle à la concentration des substances en solution, à condition de se placer à la longueur d’onde à laquelle la substance absorbe les rayons lumineux.
Loi de Beer-Lambert : définition et explications
La relation entre l'absorbance et la concentration est linéaire et est décrite par la loi de Beer-Lambert comme suit : c : la concentration molaire de la . Mesurer une conductance et tracer une courbe d’étalonnage .
Absorbance et loi de Beer-Lambert ← Mathrix
La loi de Beer-Lambert permet de calculer l'absorbance d'une solution à partir de sa concentration.Absorbance ; loi de Beer-Lambert Conductance, conductivité ; loi de Kohlrausch Exploiter la loi de Beer-Lambert, la loi de Kohlrausch ou l’équation d’état du gaz parfait pour déterminer une concentration ou une quantité de matière. En 1852, BEER complète la loi de Lambert par la relation de proportionnalité entre l'absorbance et les concentrations . Plus la concentration diminue et plus le spectre .La loi de Beer-Lambert relie une grandeur physique A, appelée absorbance, à la distance parcourue par la lumière dans la matière et à la concentration d’un soluté dans une solution aqueuse. Découvrez la méthode, le repérage et le calcul de la . Elle s’écrit pour des solutions peu concentrées et pour des sources de lumière monochromatiques :Définition de la loi de Beer-lambert. Regrouper vos mesures dans le tableau suivant : # Mesure de l’absorbance de la solution diluée d'eau de Dakin® : Adiluée =

Ce chapitre présente les notions d’absorbance et de spectre d’absorption.Nous allons vérifier la loi de Beer-Lambert disant que l’absorbance est proportionnelle à la concentration du soluté: A = k c (loi de Beer-Lambert) k est une constante pour une épaisseur de cuve donnée, une longueur d’onde donnée et un soluté donné. et de la longueur de solution à traverser L.The Beer-Lambert law tells us that the absorbance is proportional-- I should write it like this-- the absorbance is proportional to the path length-- so this would be how far does the light have to go through the solution. La loi a tout d’abord été édictée par le mathématiciens et physicien . L’intensité de la lumière transmise est donc inférieure à . Le graphique d'étalonnage est représenté ci-dessous : 1) Ce . La longueur d'onde \(\lambda\) de la lumière qui traverse la cuve. Soit une radiation monochromatique de longueur d'onde fixe traversant un échantillon d'épaisseur l, l'absorbance vérifie la loi de beer-lambert soit : A = εlc. Notes et références. On peut donc supposer la relation suivante : A = L. Articles connexes. Provenance : Académie de Limoges Loi de Beer-Lambert. Celle-ci va permettre aux élèves : de vérifier ou découvrir la loi de Beer-Lambert ; de découvrir un tableau d’évolution ou d’avancement .Une partie de cette loi empirique fut découverte par Pierre BOUGUER en 1729 , puis reprise par LAMBERT en 1760.
Absorbance, conductance, conductivité
Mode opératoire: -Vous disposez d’un flacon jaugé de 50 ml, de quatre flacons . l —1), de l'espèce absorbante ; l, le . La loi de Beer-Lambert est aussi appelée loi de Bougier, surtout en France, mais pourquoi ? Contrairement à ce qu’on pourrait penser, la paternité de la loi de Beer-Lambert est partagée par non pas deux mais trois scientifiques. Lorsqu’une lumière d’intensité passe à travers une solution, une partie de celle-ci est absorbée par le(s) soluté(s). La loi de Lambert indique que l'absorbance est directement proportionnelle à l'épaisseur du milieu traversé.La courbe repr´esentant la valeur de l’absorbance en fonction de la concentra-tion de la solution est assimilable a une droite passant par l’origine du rep`ere. 🎯 Dosage par étalonnage Exercice corrigé , absorbance, concentration, ️ Playlist : CHIMIE 🟢 1ère . On s'intéresse . Autres grandeurs en lien avec l'absorption.Apprenez à mesurer l'absorbance d'une solution colorée à partir de sa concentration grâce à la loi de Beer-Lambert. On parle aussi de transmittance définie par la relation :Loi de Beer-Lambert / Dosage spectrophotométrique Exo 5 Pour doser par étalonnage colorimétrique le carotène dans une solution de concentration inconnue, on prépare une échelle de teintes de carotène, puis on mesure leurs absorbances A à 450 nm dans des cuves de largeur l = 1,0 cm.A_\lambda : absorbance de la solution à la longueur d'onde \lambda k_{i, \lambda} : . L’analyse de la lumière transmise par une solution colorée révèle la présence d’une ou de plusieurs .Utiliser la loi de Beer-Lambert : La courbe ci-dessous représente l’absorbance A en fonction de la concentration C en diiode d’une gamme de solutions étalons.
La loi de Lambert-Beer stipule que l'absorption de la lumière lorsqu'elle traverse un milieu absorbant est directement proportionnelle à la longueur du .; La loi de Beer-Lambert donne la relation entre l’absorbance A et la concentration C : , avec : .1e Spécialité Ch 2 – La loi de Beer-Lambert TP 2) Loi de Beer-Lambert Mesurer l’absorbance de chacune des solutions préparées en commençant par la solution la plus diluée .com/Où nous trouver ?SITE DE REVISIONS LES BONS .

Critiques : 63Explorez comment la concentration et l'épaisseur d'une solution affectent l'absorption et la transmission de la lumière avec ce simulateur interactif de l'Université du Colorado. Pour chaque concentration, on mesure l’absorbance A 1, A 2, A 3, A 4.
Loi de Beer-Lambert : cours et explications │ StudySmarter
Loi Lambert-Beer
Additivité de la Loi de Beer-Lambert.4,3/5(132)
Loi de Beer-Lambert : définition et applications
Loi de Beer-Lambert.L’absorbance d’une solution contenant une espèce colorée est proportionnelle à la concentration molaire c de cette espèce et à l’épaisseur l de solution traversée par le .2 –Absorbance 3 –Loi de Beer-Lambert II –Dosage par étalonnage 1 –Préparation des solutions étalons 2 –Obtention de la courbe d’étalonnage 3 –Détermination de la concentration inconnue III –La conductivité.

On définit l’absorbance de la solution comme : = ().La loi de Beer-Lambert est une relation mathématique qui relie l’ absorbance d’une solution à la concentration de ses constituants absorbants et à la . Or another way to say . Conditions de validité : la loi de Beer-Lambert est valable pour : - une lumière monochromatique donnée (λmax).Faire des solutions colorées concentrées et diluées et explorer la quantité de lumière qu'ils absorbent et transmettent à l'aide d'un spectrophotomètre virtuel!
 Loi de Beer-Lambert.jpg)
TP03 : Détermination de la concentration d’une solution par spectrophotométrie (Chap.

La loi de Beer-Lambert est une expression qui permet de calculer l'absorbance d'une solution aqueuse pour une lumière .