Pourquoi faire l’électrolyse de l'eau
Bac S 2003-2012 Tronc commun .Temps de Lecture Estimé: 2 min
Électrolyse de l’eau
L'électrolyse de l'eau est donc une réaction chimique dont l'équation .Cellule d'électrolyse.
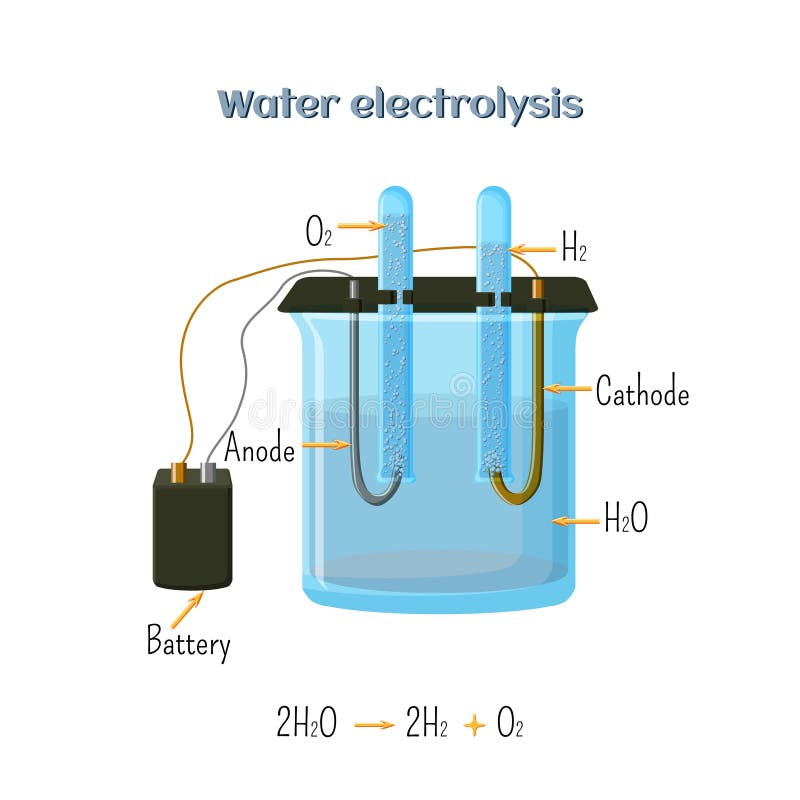
Capture d'écran d'une vidéo, mise en ligne le 10 février 2020 sur Twitter, prétendant démontrer par électrolyse la présence de pesticides dans de l'eau Cristaline . Elle est rendue possible par le passage d’un courant continu à travers deux électrodes immergées dans un électrolyte liquide ou solide.L’électrolyse de l’eau (H2O) permet (grâce à un courant électrique) de scinder les atomes d’hydrogène (H) de ceux d’oxygène (O). On va ici s'intéresser à l'électrolyse de l'eau . Pour finir cette série, je vous ai préparé un article où je vous apporte les réponses aux questions les plus fréquentes. D'abord, un électrolyseur produit de l'hydrogène.
Obtenir du dihydrogène par électrolyse de l'eau Méthode

Mettre au point une .

Synthèse de l'eau.L'électrolyse est un processus fondamental qui exploite les principes de la conductivité électrique pour effectuer des transformations chimiques contrôlées. invite2114f004.
Électrolyse de l'eau
netRecommandé pour vous en fonction de ce qui est populaire • Avis
Production d’hydrogène par électrolyse de l’eau
Mais l’eau pure est précieuse. Mais l’électrolyse se fait à partir d’eau liquide et la combustion génère de la vapeur d’eau, ce qui fait que le rendement théorique maximum de la filière est de PCI/PCS (241,8/ . L’eau qui s’écoule d’un sèche-linge à condensation ne .Ex-directrice du CEA-Liten, Florence Lambert est aujourd’hui à la tête de Genvia, société produisant de l’hydrogène décarboné à travers une technologie de .
Production de l'hydrogène
Verser le sel dans le contenant.

232 : Bilan chimique lors d’une électrolyse H 2 O liq → H 2 + ½ O 2 ΔH°(298 K) .

Mais là encore, ce n’est pas simple.Cette courte vidéo présente l'électrolyse de l'eau.
Chapitre 11 : L’électrolyse, une transformation forcée
D’autres applications .54-55 du manuel Hachette TS Spé (2012).J'avoue que l'idée de l'électrolyse de l'eau en alternatif ne me viendrait pas à l'esprit, et si ce n'était pas si risqué, je serais curieux de voir si à 50 Hz on observe réellement quelquechose.frProduire de l’hydrogène à partir d’eau de mer, c’est possiblefutura-sciences.
Hydrogène vert : qu'est-ce que l'électrolyse de l'eau
comRecommandé pour vous en fonction de ce qui est populaire • Avis
L’électrolyse de l’eau
En réalité, cette condition . L’osmose inverse se passe en deux étapes.L’électrolyse. Je contrôle mes connaissances .L’électrolyse de l’eau est un procédé chimique permettant de produire de l’hydrogène et de l’oxygène gazeux. Montrer qu'après arrêt du courant imposé, le systèm e chimique évolue selon le sens spontané et que lorsque qu'on impose à nouveau le courant, il évolue dans le sens inverse du sens spontané. Comme il s'agit d'un transfert de charge, il est important d'augmenter la mobilité des charges. Elle est rendue possible par le passage d’un courant continu à travers deux électrodes .
électrolyse
Remuez la solution pour accélérer la dissolution du sel.
électrolyse de l'eau
Production d'hydrogène par dissociation thermochimique de la vapeur d’eau.

La manipulation proposée permet d’étudier le fonctionnement d’un électrolyseur .
Électrolyse : définition et principe
Les récentes publications sur sa-piscine traitent plus particulièrement du traitement par électrolyse au sel, un mode de traitement que je n’avais que peu abordé jusqu’à présent.Principe général de l’électrolyse de l’eau L’électrolyse de l’eau est une réaction électrochimique de décomposition de l’eau en hydrogène et en oxygène.Le principe de l’électrolyse au sel est simple : le chlorure de sodium ou le chlorure de magnésium que l’on dépose dans la piscine si l’on opte pour ce procédé apporte des ions chlorures qui, grâce à l’énergie électrique, se transforment en chlore.Grâce à ses services d’accompagnement gratuits et stimulants, Alloprof engage les élèves et leurs parents dans la réussite éducative.
PRODUCTION D'HYDROGENE PAR ELECTROLYSE DE L'EAU
Un électrolyseur est constitué d'un récipient, de deux électrodes conductrices, qui trempent dans une solution contenant des ions.électrolyse de l'eau, relation entre quantité de matière d'électrons et de dihydrogène, quantité d'électricité, corrosion, anode sacrificielle.Production électrolytique d’hydrogène : Dossier complet . 1) Expérience.Au cours de l'électrolyse de l'eau, de l'eau disparaît tandis qu'il se forme du dihydrogène et du dioxygène.TP réalisé à partir de l’activité expérimentale 1 p.
TP Spé CHIMIE
231 : Électrolyse d’une solution aqueuse de permanganate 9. Les cellules électrolytiques ou d'électrolyse sont des cellules électrochimiques qui peuvent être utilisées pour l'électrolyse de certains composés.en réalité, 1,23 V est la tension théorique minimale, à pH = 0, permettant de réaliser l'électrolyse de l'eau. Quelles sont les utilisations de cette méthode ? Electrolyse de l'eau. Électrolyses 9. La quantité recommandée est d’au minimum environ 20g/litre d’eau, soit 5 cuillères à café.En principe, l’opération est blanche, puisqu’il s’agit de la même réaction réalisée en sens inverse (décomposition puis synthèse de l’eau).L'électrolyse de l'eau est l'une des méthodes d'extraction du dihydrogène disponible aujourd'hui.

Le vaporeformage consiste à contraindre un gaz carboné (méthane par .On y parvient par divers procédés : le reformage ou gazéification d’hydrocarbures, l'électrolyse de l’eau ou la dissociation thermochimique de l'eau ou de la biomasse (cf. 🚰 Une eau gazeuse, plate, fraîche ou chaude accessible 24/7.La synthèse de l'eau est la réaction chimique au cours de laquelle de l'eau est formée à partir du dihydrogène et du dioxygène. 21/11/2009, 16h53 #3. Eau et énergie :ELECTROLYSE .Production d’hydrogène par électrolyse de l’eau : les inconvénients Pour le moment, l’inconvénient majeur de la production d’hydrogène par électrolyse est son coût.En général, lorsqu’on parle d’hydrogène dans le cadre de la transition écologique, on fait plutôt référence à l’hydrogène produit par électrolyse de l’eau, qu’on appelle « hydrogène vert ».TP Spé CHIMIE – chap 03. Cette valeur correspond à la différence des potentiels standards des couples O 2 /H 2 O et H + /H 2. L’eau introduite doit être la plus pure possible car les impuretés demeurent dans l’équipement et s’accumulent au fil de l’électrolyse, perturbant in fine les réactions électrolytiques par : - la formation de boues, - l’action des chlorures sur les électrodes. à eau Exquado. Le 2 mai 1800, quelques semaines après l . Aujourd’hui très minoritaire, cette technique est pourtant particulièrement intéressante dans le cadre de la transition énergétique, dès lors que l’électricité employée est renouvelable. Dans le cas de l'électrolyse, cette solution peut être une solution d'acide .Une cellule d'électrolyse est constituée par l'immersion de deux plaques métalliques appelées électrodes dans une solution électrolytique. Introduire les notions relatives à . Il en faut même beaucoup et le bilan final est de 76 %, c . Certes, il ne faut « que » de l’eau et de l’électricité. Tant qu’il se dissout, vous pouvez en ajouter.Faire circuler un courant électrique d'intensité do nnée et mettre en évidence la formation d’un produit lors de cette transformation forcée. Par exemple, l'eau peut être soumise à une électrolyse à l'aide d'une cellule électrolytique pour former de l'oxygène gazeux et de l'hydrogène gazeux.Sur l’une des deux (la cathode), des particules chargées électriquement (les électrons) apparaissent et apportent un surplus de charges électriques aux molécules . Lorsque ce chlore entre en contact avec la matière organique de l’eau, cela . La synthèse de l'eau est une réaction . Cette expérience permet de mettre en évidence la possibilité de changer le sens d'évolution d'un système chimique en imposant un courant. La recherche se concentre donc principalement sur l’utilisation de matériaux moins onéreux et tout aussi performants pour la conception d’électrolyseurs. Le dispositif permet de détruire des molécules .Désalinisation de l’eau de mer par osmose inverse. Pour produire de l’hydrogène, l’électrolyse de l’eau apparaît comme une solution évidente.L'électrolyse et la synthèse de l'eau. Mais le procédé n’est « durable » que si l’électricité utilisée est . De mémoire, si on fait l'électrolyse de l'eau en continu, il y a un certain laps de temps avant que les premières bulles apparaissent. L’électrolyse de l’eau est l’une des voies de production du dihydrogène.comCHIMIE Troisième : L'électrolyse et la synthèse de l'eaufasoeducation. L’eau ainsi filtrée passe ensuite à travers une très fine . Exercice : Je m'exerce.c) Pourquoi avoir utilisé une solution aqueuse de sulfate de sodium et non de l’eau pure pour réaliser l’électrolyse de l’eau ? d) Quels sont les porteurs de . Parmi ces constituants, se trouvent au moins un oxydant O 1 (couple : O 1 / R 1) et un réducteur R 2 (couple O 2 / R .Regarder la vidéo3:00Cette courte vidéo présente l'électrolyse de l'eau.Salut ! Avant tout, voici une fiche qui pourrait t'être utile expliquant l'électrolyse de l'eau : L'électrolyse de l'eau est une réaction rédox.
Eau déminéralisée, pourquoi faire et comment l'obtenir
Ceci dit, si tu utilises des plaques de zinc comme électrodes, tu verras rapidement qu'elles se corrodent.Dans ce procédé, on utilise un courant électrique pour déclencher une réaction dite d’oxydo-reduction; dans la solution le courant induit un transfert d'électrons entre les ions . La réaction que l’on souhaite provoquer est : 2 H 2 O (l) → 2 H 2 (g) + O 2 (g) Pour que l’électrolyse puisse fonctionner, il est nécessaire d’imposer un minimum de 1,23 V [car on a E 0 (H 2 O/H 2) = 0,42 V et E 0 (O 2 /OH −) = − 0,81 V] par l’intermédiaire du générateur. Un électrolyseur est un récepteur électrique qui convertit de l'énergie électrique en énergie chimique.Exemple de l’électrolyse de l’eau Électrolyse de l’eau. En pratique, la tension nécessaire est plus importante à cause des phénomènes de surtensions apparaissant aux électrodes. Une spécification importante sur l’eau .est proche de 1 L/Nm3. Un courant électrique est . Elle est envisagée pour utiliser les surplus de production d’électricité. La première électrolyse a été une électrolyse alcaline. Que diriez vous d’un carburant illimité qui pourrait remplacer .Re : électrode pour l' éléctrolyse de l' eau.