Quelle est la différence entre acide et eau forte
2 - Acides forts et acides faibles.On qualifie de forts les acides et les bases qui réagissent de manière totale avec l'eau.Pour les acides forts et les bases fortes, cette réaction inverse est presque inexistante. Zones clés couvertes. Préserve son élasticité tout en assurant la régénération des tissus. C'est pourquoi on utilise uniquement des flèches unidirectionnelles. L'eau, qui est neutre, a un pH de 7.Différence entre acide faible et acide fort.le différence clé entre l'acide faible et fort est que les acides faibles s'ionisent partiellement dans l'eau tandis que les acides forts s'ionisent complètement. Chapitre 5 Macromolécules .Difficile dans ces conditions de savoir quelles sont les différences entre les deux.
Définition
Cependant, on vous le promet, il y a quand même quelques différences. On peut également . La différence entre un acide fort et un acide faible est que pour l acide fort la réaction de dissociation de l acide est totale dans l eau alors que pour l acide faible elle est partielle. Acide fort et base forte. L'acide sera donc le réactif limitant. Observez comment dans la solution de H I , un acide fort, il y a une ionisation complète en ions I – et H O 3 + , alors que dans la solution de H F , un acide faible, il reste quelques molécules de H F présentes dans la solution qui n'ont pas . La force d'un acide .
Les acides et les bases
Vous pourriez avoir besoin de : La classification périodique des éléments. Ce n'est pas, ce que beaucoup supposent à tort être la concentration d'un acide dans une solution.Quand on parle d'acides ou de bases forts, il s'agit de substances qui se dissocient ou s'ionisent complètement en solution.
Acides et bases forts et faibles : définitions
Il en est de même avec l’acide chlorhydrique et l’acide citrique. Bien que forte les acides peuvent être très corrosifs et provoquer de graves brûlures, les acides faibles . Initialement, d’après le chimiste suédois Arrhénius, étaient considérés comme acides, les composés capables de libérer un cation H + en solution aqueuse, et considérés comme bases, ceux capables de libérer un anion OH-. Un acide faible AH réagit avec l’eau selon une réaction limitée : AH (aq) + H 2 O (l) A – (aq) + H 3 O + (aq).
Les acides forts et faibles
D'une manière générale, les acides sont des substances dont le pH est inférieur à 7, tandis qu'un niveau supérieur à cette valeur indique qu'il s'agit de bases.L'acidité de l'eau est une quantité, exprimée en milliéquivalents par litre d'eau, de base forte qui doit être utilisée pour neutraliser les acides forts contenus dans un .
Classement des acides (ou bases) forts dans l'eau
Définir la constante d’acidité K a et de . C'est un réactif en excès. L’eau-forte peut servir la taille . Le premier est un monoacide liquide ou une solution aqueuse tandis que le second est un végétal organique naturel faible, présent sous .Selon Bronshted un acide est une donneur de proton. L’acide chlorhydrique est .
Révision sur le pH, les acides et les bases
Celle-ci sera fixée à 25 °C. Les bases ont un pH compris entre 7 et 14, les bases les plus fortes étant les plus proches de 14. Chapitre 12 La respiration cellulaire. Ka et Kb sont liés l'un à l'autre par la constante ionique de l'eau, Kw : Kw = Ka x Kb. Les solutions acides ont un pH faible, inférieur à 7. Chapitre 10 Membranes et transport . Elle est par définition plus réactive que la chaux éteinte. En examinant le pH de chaque solution à 0,1 M de chaque acide faible, il est important d’apprécier l’ampleur considérable de la .
Quelle est la différence entre un acide et une base
L'eau est à la fois un acide et une base.
Chapitre 17 Les acides et les bases
La bonne nouvelle, concernant les acides forts, c'est que tout .Prévoir la composition finale d’une solution aqueuse de concentration donnée en acide fort ou faible apporté. Comparer la force de différents acides ou de différentes bases dans .
Différence entre les oxydes acides et basiques
L'acide nitrique . Expliquer la notion de forces des acides et des bases en termes de dissociation. Pour simplifier, la chaux hydratée est le résultat d’un ajout d’eau à de la chaux vive en poudre, que l’on place dans un four, puis qu’on pulvérise avec de l’eau.En revanche, il est plus difficile de retenir les noms et les structures des acides aminés et des acides forts.Quelle est la différence entre le botox et l’acide hyaluronique ? Publié le 20 août 2021 à 10h38 - Mis à jour le 15 février 2024 à 12h08.Connaissez-vous la différence chimique entre un Acide et une Base? Si ce n’est pas le cas, voici une explication, ainsi qu’une astuce pour ne plus jamais se tromper entre Acide et Base. Chapitre 8 Structure d'une .
pH, pOH et échelle de pH (leçon)
L'acide sulfurique est un exemple d'acide fort , et le fluorure d'hydrogène est un acide faible. Chapitre 7 Énergie et enzymes.Commencer à s’entraîner.1 Définition d’Arrhénius.
Reconnaître des acides forts et des acides faibles
Le pH est une mesure de l’activité chimique des ions .Les figures suivantes illustrent la différence de comportement entre un acide fort (H I) et un acide faible (H F) dans l’eau.Reconnaître des bases fortes et des bases faibles.

On nomme eau-forte, l’ensemble des procédés de gravure chimique. Google Classroom.; Base: Substance qui libère des . L'acide hyaluronique et collagène sont tout aussi importants l'un que l'autre pour votre corps et vous permet également de lutter contre l'apparition des rides et ridules.Un acide et une base sont tous deux des composés chimiques qui modifient le pH, ou la concentration en ions hydrogène, de l’eau dans laquelle ils sont dissous.Ka et pKa concernent les acides, tandis que Kb et pKb concernent les bases. B + H + BH + avec B la base et BH + l'acide conjugué.Pour un couple donné, la constante d’acidité ne dépend que de la température. Plus un acide s'ionise, plus il est fort et moins la production d'ions . En solution aqueuse, l'acide acétique ou acide éthanoïque, CH 3 COOH , est-il un acide fort ou un acide faible ? Apprenez gratuitement les Mathématiques, l'Art, la Programmation, l'Economie, la Physique, la Chimie, la Biologie, la Médecine, la Finance, l'Histoire et plus encore. Cela peut peut-être prêter à confusion, mais plus le pH d'une substance est faible, plus il est acide. Un acide fort AH est un acide qui réagit totalement avec l’eau : AH (aq) + H 2 O (l) → A – (aq) + H 3 O + (aq). Les mordants les plus employés sont l’acide nitrique et le chlorure ferrique en solutions aqueuses.• Un acide fort est un acide réagissant totalement avec l’eau. On dit que l'eau est amphotère: Les couples acides/bases sont H 3 O + /H 2 O et H 2 O/OH -.Le terme d’acide chlorhydrique désigne une solution aqueuse incolore de chlorure d’hydrogène (HCl) composée d’ions hydronium, H3O+, et d’ions chlorure, Cl-. Ensuite, nous examinerons l'ionisation des acides et des bases faibles et comment mesurer le pH. Il est égal à Ke = [OH - ] [H +] = 10 -14 à 25°C.
Eau, acides et bases
Reconnaître des acides forts et des acides faibles.
Bronshted se met du point de vue du chlore qui donne un proton. [A] Dans une solution aqueuse, un . La force d'un acide est sa capacité à ioniser ou donner l'ion hydrogène dans une solution aqueuse réagissant avec de l'eau.La principale différence entre l'acide minéral et l'acide organique est que les acides minéraux sont des composés inorganiques composés de différentes combinaisons d'éléments chimiques alors que les acides organiques sont des composés organiques essentiellement composés d'atomes de carbone et d'hydrogène.Différences entre l’urée et l’acide urique.Le tableau ci-dessus donne les constantes d’ionisation pour plusieurs acides faibles, y compris le pH pour une solution de 0,1 M de chaque acide ; des constantes d’ionisation supplémentaires sont présentées à l’ annexe H.
Les installations d’eau déminéralisée sont plus économiques que la distillation pour la plupart des applications industrielles.Si un oxyde réagit avec une base mais pas avec des acides, c'est un oxyde acide. Les acides forts et faibles ne sont pas les mêmes que les acides concentrés . Virginie Koerfer. • Un acide faible AH réagit avec l’eau selon une réaction limitée. L'ionisation, la dissociation d'un acide ou d'une base faible, est une réaction réversible.

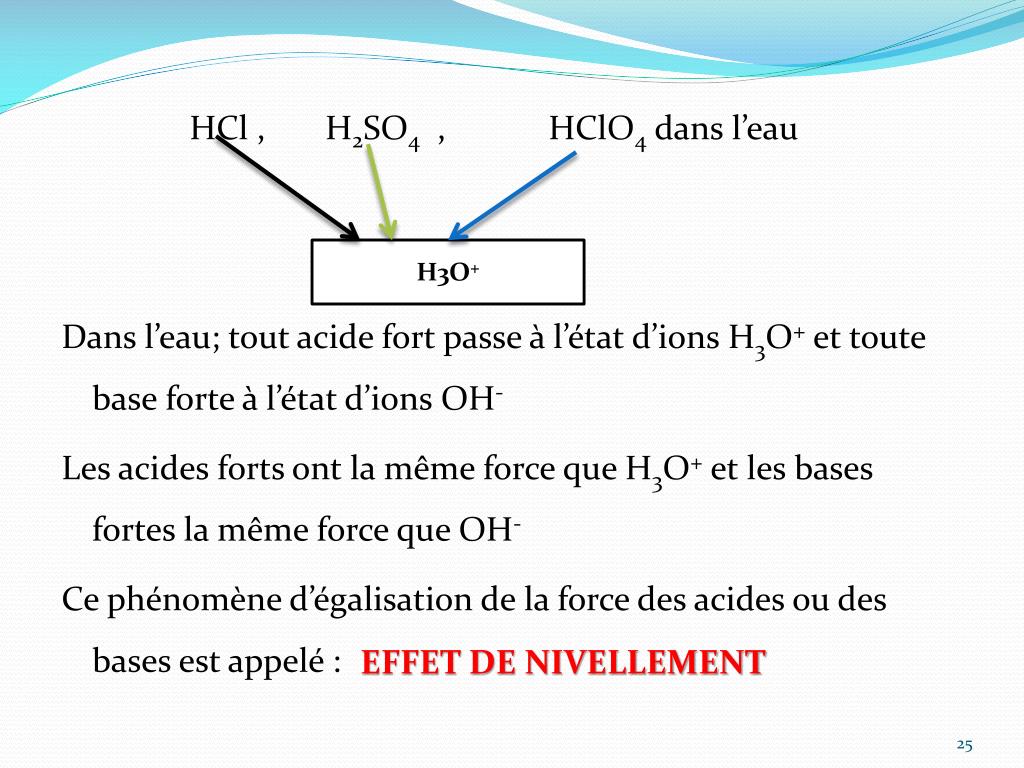
Donc il va y avoir un transfert d'un ion H+ d'une molécule à l'autre comme par exemple HCl+H2O---> Cl- + H3O+. Voilà pourquoi on estime qu’il est très intéressant de combiner les deux.La chaux vive a une densité élevée (0,9). Elle peut être coûteuse car la distillation est coûteuse pour chauffer, faire circuler, refroidir et entretenir de grandes quantités d’eau pour la production industrielle.On a donc pour l’acide H 3 O + Q = Ka = 1 ou encore pKa = 0. Tout d'abord, nous allons définir l' acide et la base. Le pH vaut donc 7. Concrètement, est indépendante des conditions initiales, c'est-à-dire de la concentration initiale en acide faible dissous, contrairement à .La différence entre acide citrique et acide chlorhydrique. À l'inverse, les acides et les bases faibles ne . En solution aqueuse, un acide est défini comme un composé qui augmente la concentration en H 3 O + ( a q) , alors qu'une base augmente la concentration en . Comme le pH et le pOH , ces valeurs tiennent également compte de la concentration en ions hydrogène ou protons (pour Ka et pKa) ou en ions hydroxyde (pour Kb et pKb). Puis, nous étudierons homéostasie et le déséquilibre acido-basique comme l' acidose et l' alcalose. AH est l'acide conjugué de A - et A - est la base conjuguée de AH. Références: 1. Chapitre 9 En savoir plus sur les cellules.
Reconnaître des bases fortes et des bases faibles
Ensuite, nous examinerons l'ionisation des acides et des .
Quelle est la différence entre le botox et l’acide hyaluronique
(H+) Selon Lewis un acide est un accepteur de paire d'électrons. Injectés par un médecin .Un faible pH signifie un acide fort, un grand pH signifie une base forte. Reconnaître des acides forts et des acides faibles.

Bien que l’urée et l’acide urique soient tous deux des produits de dégradation métabolique, ils présentent des différences importantes.Lequel des énoncés suivants décrit correctement la différence entre un acide fort et un acide faible ? En solution aqueuse, un acide fort s’ionise partiellement, tandis qu’un . Considérons un acide A correspondant à un couple Acide-base de pK a < 0 (K .Un acide fort est un acide qui est ionisé à 100 % dans une solution, et un acide faible est un acide qui ne s'ionise pas complètement lorsqu'il est dissous dans l'eau. Structure chimique.Eau, acides et bases.La réaction acido-basique entre un acide fort et une base forte est toujours une réaction totale et quasi-instantanée. Chapitre 4 Propriétés du carbone . Sa formule chimique est (NH₂)₂CO, ce qui signifie qu’elle est .
Acide et base : définitions (vidéo)
Cependant, notez l’alcalinité dans la colonne centrale. Dans l'état final, la concentration en acide sera donc .Je ne comprends pas la différence entre un acide faible et un acide fort !!

Comparer la force de différents acides ou de différentes bases dans l’eau.
Quelle est la différence entre acide citrique et acide chlorhydrique
Quel que soit le pH de départ, plus l’alcalinité de la source d’eau est élevée, plus il faut d’acide pour réduire le pH à 5. Dans cette expression, les concentrations doivent obligatoirement être exprimées en mol/L et à l’équilibre chimique, .Tu peux utiliser une sonde PH ou du papier PH pour aller plus vite si ta solution le permet.










