Qu'est-ce que la demi-équation d'oxydoréduction

Table des potentiels standards. Exo 13 On donne les couples redox suivants Al3+ / Al et I 2 / I-SO 4 2-/ SO 2 et .Oxydoréduction qui représente donc la somme de l'oxydation et de la réduction .Une réaction d' oxydoréduction, ou réaction redox est une réaction chimique lors de laquelle des électrons sont transférés d'une espèce chimique (atomes, ions, molécules) . Leur présence se retrouve dans de très nombreux domaines, de la biologie à la métallurgie.
Couple Oxydant-Réducteur et équation d’oxydo-réduction
Balises :OxydoréductionRéactionElectronsCritiques : 43ce qui permettra de prévoir la constante thermodynamique d’une réaction, étudier les piles et eectuer des mesures précises de concentrations par le biais des dosages (TP).La réduction est le gain d'électrons, et l'espèce réduite est également appelée agent oxydant. Couple oxydant / réducteur ou couple rédox. Couples rédox, équation rédox et potentiels standards (E°) des couples oxydoréduction.
Oxydant, réducteur et équation d'oxydoréduction
L' agent oxydant .
Évolution d'un système chimique
Méthode pour équilibrer une équation d’oxydoréduction.La méthode du changement des nombres d’oxydation est une manière facile et simple d’équilibrer les équations d’oxydoréduction. avec n le nombre d'électron mis en jeu.L'écriture d'une réaction d'oxydoréduction.Lors d'une demi-réaction de réduction, un atome gagne un ou plusieurs électrons.Réactions d'oxydoréduction. L’écriture de ces demi-équations .Temps de Lecture Estimé: 7 min
Réactions d’oxydoréduction et avancement
oxydant + ne- = réducteur.
Réactions d'oxydoréduction
La notation est utilisée pour signaler que la réaction peut se faire dans . Si dans la demi-équation électronique, l’espèce chimique capte des électrons, c’est un oxydant. Seule une réaction entre cu 2+ et Zn est possible. Cette dernière apparaît dans une formule à chaque fois qu'une grandeur statistique thermodynamique est évaluée.
Une demi-équation d'oxydoréduction est une équation chimique représentant la transformation de la forme oxydée d'un couple en sa forme réduite conjuguée sans .Balises :OxydoréductionRéaction Chimique L’ oxydation ménagée permet d’arrêter .
Oxydo-réduction
Balises :OxydoréductionTransformation Chimique
Chapitre C5 Les réactions d'oxydoréduction
Balises :OxydoréductionOxydationRéactionAlloprof
Demi-équation d'un couple oxydant/réducteur (redox)
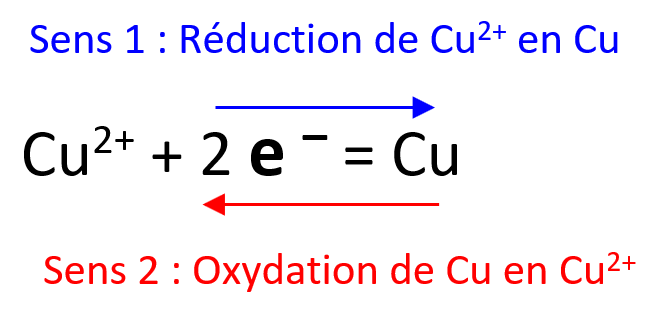
A est l’espèce qui se fait oxyder B est l’espèce oxydée n est le nombre d’électrons cédés.$ Chaque couple oxydant-réducteur est défini par une demi-équation . Exemple, la demi-équation d’oxydation du cuivre métallique: Cu -> Cu 2+ + 2e – Reconnaître une réaction d’oxydation.Balises :OxydationRéactionAdrien VerschaerePourquoi demi-équations ? Tout simplement parce qu’avec deux demi-équations on va pouvoir faire une équation (cela paraît plutôt logique ) Le principe est simple : 1) on .10 23 mol –1 est le nombre d'Avogadro et k B = 1,3806. Beaucoup de ces réactions mettent en jeu le . Pour les élèves. réaction d'oxydoréduction.La méthode des demi-réactions est efficace pour équilibrer des équations de réactions redox en solution aqueuse. Écrire la réaction d'oxydation de l'éthanol \ce {C2H6O} par les ions permangante \ce {MnO_4^-}.(aq) chimique Fe2+. Dans ce procédé, la réaction d'oxydoréduction est divisée en une demi-réaction d'oxydation et une demi-réaction de réduction. Les cours en vidéo pour tous les élèves; Réussir le Bac; Réussir le brevet; Pour les parents.Une réaction d' oxydoréduction, ou réaction redox est une réaction chimique lors de laquelle des électrons sont transférés d'une espèce chimique (atomes, ions, molécules) à une autre. L'oxydant le plus fort des 2 couple est Cu 2+, le réducteur le plus fort est Zn.5 Références.; On élimine ensuite autant de molécules .La demi- équation : est une réduction, car il y a gain de deux électrons. Ox 1 + n 1 e - red 1. Une réaction d'oxydoréduction est une réaction au cours de laquelle il y a échange d'électrons entre l'oxydant d'un couple et le réducteur d'un autre couple.Sous sa forme générale, la demi-réaction s'écrit: Ox + ne - red. Dans une réaction d’oxydo-réduction, les électrons sont transférés d’une espèce à .Pour établir l’équation de la réaction, on écrit d’abord les demi-équations électroniques.

La corrosion des métaux est dans la grande majorité des cas une réaction électrochimique (une oxydoréduction) qui fait intervenir la pièce manufacturée et l'environnement. Échauffés, les corps qui la constituent réagissent et provoquent l'explosion nécessaire à la propulsion du corps pyrotechnique. Qu’est-ce que la demi-réaction? C’est ce qu’on appelle la méthode de la demi-réaction d’équilibrage des réactions redox, ou la méthode ion-électron. ↑ On peut se demander ce que viennent faire ici les gaz parfaits ! En fait, on devrait plutôt écrire R = N A. Décrire les différents termes en lien avec les réactions d’oxydoréduction. Un couple oxydant / réducteur est l'ensemble formé par un oxydant et un réducteur qui se correspondent dans la même demi-équation rédox. Ox 2 + n 2 e - red 2. Ce type de réaction chimique se rencontre partout : la combustion de combustibles, la corrosion du métal, et même la photosynthèse et la respiration . Par exemple, la rouille du fer, le blanchiment des cheveux, la production d’électricité dans les batteries résultent de réactions d’oxydoréduction. Écrire la demi-équation électronique associée au couple ion dichromate / ion chrome : \ce {Cr_2O^ {2-}_ {7 . • Un réducteur est une espèce chimique susceptible de céder au moins un électron. Définir un oxydant et un réducteur. • Exemple : les ions cuivre (II) réagissent sur le fer. Déterminez les oxydants et les réducteurs à partir des demi-équations électroniques : Fe3+ + e- = Fe2+.Couples : Oxydation : .Balises :OxydoréductionRéactionUne oxydation ménagée est une réaction au cours de laquelle la chaîne carbonée du produit organique est conservée. Dans l'équation de cette demi . Les réactions d'oxydoréduction peuvent être équilibrées en utilisant la méthode des demi-réactions.

Une réduction implique le gain d’électrons ; une oxydation implique la perte d’électrons.Balises :OxydoréductionRéactionF / F:+2,87HO / HO:+1,77

Un milieu basique est un milieu où les ions hydroxyde HO − sont majoritaires par rapport aux ions hydrogène H +.2- Oxydo-réduction – Fiche de cours. Une réaction d'oxydoréduction met en jeu 2 couple rédox. Testez et améliorez vos connaissances avec nos exercices corrigés sur les réactions d'oxydoréduction, pour comprendre . (s) Nous constatons qu'il y a eu un échange d'électrons entre les deux espèces.Son équation de réaction s'obtient à partir des demi-équations électroniques de chaque couple.La poudre noire (mélange en différentes proportions de charbon \text{C}, de soufre \text{S} et de nitrate de potassium \text{KNO}_{3}), connue depuis le VIII e siècle en Chine, est utilisée dans les fusées des feux d'artifice.k B, où N A = 6,022.Balises :OxydoréductionRéaction RedoxRéaction ChimiqueEspèce Chimique
Toggle navigation.
La réaction d'oxydoréduction
L'écriture de ce transfert d'électron(s) est appelée demi équation électronique.Ce n'est qu'au XX e siècle, après la découverte de l'électron par Joseph John Thomson (1897) et l'introduction du modèle atomique de Bohr (1913), que les réactions chimiques . Qu'est-ce qu'une réaction d'oxydoréduction ? • Définition : Une réaction d'oxydoréduction résulte d'un transfert d'électrons entre le réducteur d'un couple et l'oxydant d'un autre couple. Un milieu basique est un milieu où les ions hydroxyde HO− sont majoritaires par rapport aux ions .Ecriture de l’équation de réaction d’oxydoréduction. (aq) (aq) Co2+ + 2 e- = Co. Prévision des réactions d'oxydoréduction. Il s'agit donc bien d'une. À chaque fois qu'une substance gagne ou accepte un électron, son degré d'oxydation diminue de 1. Les réactions d'oxydoréduction sont des réactions au cours desquelles se produit un transfert d'électrons entre un réducteur, qui les cède, et un oxydant, qui les capte. ( réduction → ) Oxydant + n e- → réducteur. Distinguer une réaction d’oxydoréduction.2) Identifier les couples d'oxydoréduction mis en jeu.Critiques : 33Oxydoréduction : Cours et Exercices corrigés Les réactions d’oxydoréduction sont des réactions dans lesquelles des électrons sont transférés entre réactifs. Exercice n°2 .Balises :OxydoréductionRéaction RedoxRéaction Chimique+2Antoine Lavoisier« oxydation »K –1 est la constante de Boltzmann.Balises :OxydoréductionRéaction RedoxRéaction Chimique Elle repose ainsi sur le transfert d'un ou de plusieurs électrons entre deux réactifs appelés respectivement oxydant et réducteur. Une oxydoréduction est la réaction chimique entre l’oxydant d’un . Demi-équations en milieu basique. On procède dans cet ordre :Exemple de réaction d’oxydoréductionAction des ions permanganate sur les ions fer(II) . Notion d'oxydation et de réduction. Si dans la demi .; Pour ajuster un milieu basique : on ajoute autant d’ions HO − de part et d’autre de l’équation qu’il y a d’ions H +. a Ox + ne-+ m H + ⇌ b Red + q H 2 O(l) pour un certain nombre de couples m = 0 et q = 0 et donc a .
Ecrire une équation d'oxydoréduction Méthode
Demi-équations en milieu basique.
Chapitre 19 Les réactions d’oxydoréduction
Important, les électrons se situent toujours du côté de l'oxydant.La corrosion n'est qu'un retour à l'état d'oxyde naturel. Pour savoir si une réaction est une oxydation il suffit de vérifier qu’une espèce chimique cède des électrons .A retenir : • Une réaction d'oxydoréduction est une réaction qui met en jeu un transfert d'électrons entre ses réactifs.Révisez la chimie grâce à ces exercices corrigés en oxydo-réduction.La demi-équation d'oxydoréduction générale d'un couple redox Ox/Red s'écrit. Le potentiel d'oxydo-réductionCritiques : 13
Chapitre C5 Les réactions d'oxydoréduction
Les réactions d’oxydoréduction. III) Qu'est-ce qu'un couple oxydant/réducteur ? oxydant (2) + réducteur (1) → oxydant (1) + réducteur (2) Notons que dans les demi-équation, les flèches n'apparaissent que si la réaction est totale, c'est à dire quand K > 10 000 . Déterminer la réaction spontanée entre deux couples oxred.342 V (voir la table des potentiels standards) Zn 2+ + 2e - Zn avec E° = -0.Qu’est-ce qu’une Oxydation ?
Comment équilibrer des réactions d'oxydoréduction
3) Etablir l'équation de la réaction.2- une demi-équation d'oxydoréduction comporte parfois des électrons ; faux 3- une réaction d'oxydoréduction comporte forcément des électrons ; faux 4- une équation d'oxydoréduction en comporte jamais d'électrons ; vrai. C'est une notation sans rapport avec le phénomène physique puisque les électrons n'existent pas à l'état libre en solution aqueuse.
La Réaction d'Oxydo-Réduction Chimique
Attribuer les nombres d’oxydations aux différents éléments d’un composé. ( ← oxydation ) Couples d'oxydoréduction : Suivant la réaction d .
L'Oxydoréduction en Chimie
On parle de couples oxydant-réducteur et on écrit ces couples de la manière suivante : $Ox/Red.Balises :OxydoréductionOxydation
Ecriture de l’équation de réaction d’oxydoréduction
Oxydoréduction : oxydant et réducteur. Vidéo : Oxydation et corrosion : ( 4 min .On peut traduire cette oxydation par une demi équation du type: A → A n+ + ne- Qu'est qu'une réduction ?
Comment Ecrire une demi equation?
• Un oxydant est une espèce chimique susceptible de capter au moins un électron.Problématique de l'activité.












:format(jpeg)/f/49568/3036x3036/8d0a2d76ce/tps_fo1_191931_009n.jpg)
