Réaction acide base eau
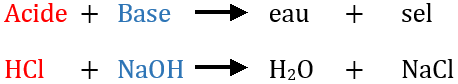
Les cations H + provenant de l'acide et les anions OH - provenant de la base réagissent . Il y a donc des ions libres dans l'eau. Exemple : Écrire la réaction entre l'ammoniac et l'acide acétique, puis entre l'acide phosphorique et la soude. H 2 SO 4 + H 2 O --> HSO 4- + H 3 O +. Vous connaissez la grandeur pH : elle permet de savoir dans quelle mesure une solution est acide (pH<7) ou basique .
Relation entre Ka, Kb et le pH.Selon la définition de Brønsted-Lowry, une réaction acido-basique est réaction au cours de laquelle il y a un transfert de proton d'un acide vers une base.
Question réaction acide sulfurique + eau [Term S]
Réaction d'un acide avec l'eau.Dans le couple acide-base H 2 O / HO –, l’acide est la molécule d’eau H 2 O et la base qui lui est associée est l’ion hydroxyde HO –.
Acides, bases, pH et pKa

L'eau déminéralisée contient donc des ions.La réaction met en jeu deux couples acide-base dont l’acide d’un couple réagit avec la base du second par transfert de proton. L'équation de la réaction est : H 2 SO 4 + H 2 O → H 3 O + + HSO 4 -. Couple H2O(ℓ) /HO −(aq) H 2 O cède un proton : H2O ⇄ H+ + HO −. 184K subscribers.Acides et bases faibles dans l'eau.
Les réactions acides bases
Une réaction acido-basique (ou réaction acide-base) est donc un échange de proton entre un donneur de proton (forme acide d’un couple 1) et un accepteur de proton (forme basique d’un couple 2) : défaut d’une base ou d’un acide spécifique, ce sera le solvant qui jouera ce rôle :(aq): dans ce couple l’eau est un acide H2O = HO-(aq) + H + L’eau peut être un acide ou une base. Réaction chimique par échange de proton. I- Produit ionique de l’eau et application.Re : Question réaction acide sulfurique + eau [Term S] Quand on dit que l'acide sulfurique est un acide fort on parle de sa première acidité. elle peut céder un ion hydrogène H +.frTP N°1 : DOSAGE D’UNE SOLUTION DE SOUDE PAR UNE . Partie du programme de physique -chimie de terminale spécialité sur les transformations acide-base: Les acides et bases. Lien avec le pH. elle peut capter un ion hydrogène H +.
Alloprof aide aux devoirs
Réactions acido-basiques. L’acide HA H A et la base A^- A− . On dit que l’eau est un ampholyte ou une espèce amphotère.L’enjeu de cette fiche est de s’intéresser plus précisément aux réactions acides bases.Chapitre 1 - Réactions acide-base.Lorsque l'on fait réagir une solution basique avec une solution acide, les ions hydrogènes (H +) et les ions hydroxydes (HO –) réagissent pour former de l'eau H 2 O.Fiche de synthèse n°2 Réactions acido-basiques en . L’eau H 2 O est un acide de Brönsted car : elle peut capter un électron. Ka et pKa : diagrammes de prédominance. 1)- Autoprotolyse de l’eau.

du couple HA1/A 1 - et A - du couple HA 2/A -.Équation bilan : C 2 H 5 O - + H 2 O → C 2 H 5 OH + HO -. Soit la demi-équation acido-basique : Le . Il est important d'ajouter de l'acide sulfurique à l'eau et non de l'eau à l'acide . Cours : Chimie > Chapitre 10.Les acides et bases qui ne sont pas forts sont des acides et des bases faibles. Cette réaction produit un autre acide : HSO4- mais qui est un acide faible donc qui ne se dissociera pas totalement dans l'eau (sans base). Le pH (potentiel hydrogène) est une grandeur qui donne une information sur la concentration en ions oxonium [H3O+]. Voici l'équation de la réaction acido-basique de l'eau : Les couples acides-bases sont : H 2 O/OH-et H 3 O + /H 2 O. Deux réactions: La constante d'acidité permet de comparer la force des acides et bases faibles.Transcription de la vidéo. Lorsqu'un acide ou une base sont considérés comme forts, cela signifie qu'ils sont capables de se dissocier complètement dans une solution.
Réaction acide-base : cours de chimie │ StudySmarter
Dans une réaction acido-basique ou réaction de neutralisation, un acide et une base d'Arrhenius réagissent habituellement pour former de l'eau et un sel. Une mole de HNO 3 . Réaction dont les produits sont majoritaires devant ceux des autres réactions, en général celle dont la constante d'équilibre est la plus élevée. Réaction acido-basique.Regarder la vidéo13:10Acido-Basique: Réaction Base avec Eau ( résumé + astuces) - avec Prof. La molécule d’eau H 2 O appartient ainsi à deux couples acide-base : elle joue le rôle d’une base pour le premier couple et d’un acide pour le second couple.
Réaction équilibrée d'une base faible avec l'eau
I- Les acides et les bases selon Bronsted .ac-montpellier. 3- L'eau : une espèce amphotère :Une neutralisation acidobasique est une réaction entre un acide et une base au cours de laquelle se forment un sel et de l'eau.La réaction Acide-base est une réaction où il y a formation d'eau (H 2 O) et de sel.
Réaction acido-basique — Wikipédia
comRecommandé pour vous en fonction de ce qui est populaire • Avis
Théorie de Brønsted-Lowry des acides et des bases
Les produits formés par les réactions acide-base sont un sel et de l'eau.alors je rappelle ici l'équation générique d'une réaction acides bases donc on a un incident agen qui réagit sur l'eau donc pour échanger un proton est donnée h 3 ou plus et la .K eq (pour la réaction acide-base en question) = 10 ΔpKa.Auteur : Noureddine PhysiqueLa mesure de conductivité obtenue n'est pas nulle, à 25°C, la conductivité de l'eau déminéralisée est de 5,5 .
Généralités sur les réactions acide-base ← Mathrix
III Les réactions acido-basiques : Celles-ci s’effectuent entre un acide et une base mais jamais entre deux acides entre eux, ni deux bases entre elles. Acides forts et acides faibles La réaction de l’acide avec l’eau Un acide (que nous noterons « 𝐴𝐻 ») réagit ave l’eau selon la réa tion d’équation :Un couple acide-base est composé d'un acide et d'une base liés par le transfert d'un ion hydrogène qui est illustré par une demi-équation acidobasique. 1-1/ Exemple de réaction acido-basique. On définira ce qu’est une réaction acide base, et les grandeurs qui permettent de caractériser . Une solution saline peut être acide, basique ou neutre.Propriétés acido-basiques des sels. Réaction des acides et des bases faibles dans l'eau, constante d'équilibre Ka et Kb. Premier indice.

2)- Avancement final de la réaction d’autoprotolyse de l’eau. Appliquons cette définition à un exemple de réactions acide base. La réaction entre l’acide nitrique H . Google Classroom. alors je rappelle ici l'équation générique d'une réaction acides bases donc on a un incident agen qui réagit sur l'eau donc pour échanger un proton est donnée h 3 ou plus et la base conjuguer c'est à dire ici à moins donc il s'agit bien d'une réaction d' équilibre elle se produit dans les deux sens et la .III- Équation chimique d’une réaction acido-basique 3-1/ Caractéristiques 3-2/ Indicateurs colorés acido-basiques 3-3/ Exemples de couples acido-basiques IV- Exercices 4-1/ Exercice 1 4-2/ Exercice 2 4-3/ Exercice 3 4-4/ Exercice 4 . Alain Sevin, François Volatron, Françoise Brochard-Wyart, et al.
Les réactions entre solutions acides et basiques
3,8/5(32)
Réactions acido-basiques impliquant l'eau
Acides et basess.Lorsque vous mélangez de l'acide sulfurique et de l'eau, l'acide sulfurique donne un ion hydrogène, produisant l'ion hydronium. Soit un acide AH qui appartient au couple AH / A –. Malgré la présence de cette réaction acido-basique dans l’eau pure, il s'agit d'une solution neutre. Par contre, si le cation a tendance à arracher un ion hydroxyde à l'eau, la solution . Un couple acide/base HA/A^- H A/A− est défini par la demi-équation acido-basique : HA\longrightarrow A^-+H^+ H A A− +H +. L’eau joue donc le rôle de base .
Écrire l'équation d'une réaction entre un acide et une base
4)- Les solutions aqueuses et le produit ionique de l’eau. Acides et bases en solution aqueuse 3.
Acides et bases faibles dans l'eau (leçon)
Acido-Basique: Réaction Base avec Eau ( résumé + astuces) - avec Prof. Réaction équilibrée d'une base faible avec l'eau.Les réactions acide-base dans l’eau.
Fiche de synthèse n°3 Acides, bases et réactions acido-basiques
L'acide sulfurique devient sa base conjuguée, HSO 4 - .

Noureddine#Chimie #Acido_Basique #Réaction_Base_avec_Eau #Résumé #Astuces #Noureddine_.Réactions acido-basiques. Réaction d'oxydoréduction Réaction de neutralisation. I- Introduction II- Autoprolyse de l’eau 2-1/ Définition 2-2/ Taux d’avancement final de la réaction d’autoprotolyse III- Produit ionique de l’eau IV- Constante d'acidité d'un couple acide-base 4-1/ Définition 4-2/ Relation entre le pH et p . Considérons une réaction entre la méthylamine et l'acide acétique : Premièrement, nous devons identifier les espèces acides des deux côtés de l'équation. Couple C 6 H 5 NH 3+(aq) / C6H5NH2 (aq) Au cours de cette réaction, l’eau cède un proton et donne sa base conjuguée l’ion hydroxyde . On considère la réaction de cet acide AH avec l’eau H 2 O. Noureddine - YouTube. Soient deux couples acide-base A 1 H/A 1 – et A 2 H/A 2 –.2- Réactions acido-basiques : Une réaction acide-base est une réaction d'échange d'ion H+ entre un donneur de H+ (acide) et un accepteur d'ion H+ (base).Les réactions acido-basiques − Notion d’acide et base selon de Bronsted 1- Exemple de réaction acido-basique : Réaction entre l’acide nitrique et l’eau : La réaction entre l’acide nitrique 3 et l’eau produit des ions nitrate 3− et des ions oxonium 3 + selon la réaction suivante : 3 ( )+ 2 ( ) 3 (𝑎𝑞) Cas particulier : les ampholytes.Les réactions acide-base. base 1 + acide 2 → acide 1 + base 2. Sur le côté gauche, l'acide .Une réaction acide-base a lieu entre un acide appartenant à un couple et la base appartenant à un autre couple, par échange d’un ou plusieurs protons. Le produit ionique de .
Semestre 2
Apprends avec 15 fiches de Réaction acide-base dans . Comment le déterminer ? En étudiant la réactivité de chacun des ions avec l'eau. Chapitre ; Auteurs . Ou ΔpKa Δ p K a est le pKa p K a de l'acide du produit moins pKa p K a d'acide réactif. Le pH de la solution S est égal à 1,70. Solution d'acide acétique K1, C. Si tu veux en savoir plus sur les réactions acide-base, consulte Réactions acide-base.Une réaction acido-basique (aussi appelée réaction par transfert de proton) est la transformation chimique qui a lieu lorsque l’acide d’un couple échange un proton avec la base d’un autre couple pour former leurs base et acide conjugués.La réaction acido-basique entre un acide AH et l'eau met en jeu les couples acido-basiques et selon la réaction : Définition Acide fort. Couple acide-base. Deuxième indice.II DEFINITION DE LA REACTION PREPONDERANTE (RP).
Séance 15
Dans ce chapitre nous allons voir ce qu’est un acide, une base, et tous les calculs et formules liés aux réactions acido-basiques. Réaction entre HA.Dans les réactions suivantes, déterminer si l'eau joue le rôle d'un acide, d'une base ou aucun des deux.Réaction équilibrée d'une base faible avec l'eau (vidéo) | Khan Academy. correspond à un échange de proton entre l’acide d’un couple. H + OH − H 3 O +. Dans Le cours de chimie générale (2021), pages 312 à 313; Acheter le chapitre 5€ Citer ou exporter Partager. L’éthanol, acide conjuguée de l’ion éthanoate, ne réagit pas avec l’eau : c’est un . Dans le cas d'un acide fort la .







