Réaction titrage acide ethanoique

Écrire la demi-équation de chacun des couples acide/bases impliqués et l’équation de la réaction du titrage. Les produits formés sont alors les espèces conjuguées des réactifs.Cette réaction conduit à un équilibre caractérisé par la constante d'équilibre.- Adapter le réfrigérant et porter le mélange à l'ébullition douce pendant 45 min. Savoir repérer précisément l’équivalence . Écrire la réaction support du titrage, supposée totale. Calculer la concentration molaire apportée c en acide acétique dans la solution . L’acide NH qui réagit va perdre son proton et le donner à la base HO –.
Les transformations acidobasiques en solution aqueuse Cours
Bilan : CH 3 COOH .1 pH d’une solution aqueuse . Le réactif de titrage est un agent réducteur ou oxydant.comTitrage acido-basique par mesure de PH: CH3COOH . On réalise le titrage conductimétrique d’un volume V = 10,0 mL d’une solution S d’acide éthanoïque (CH 3 CO 2 H) de concentration c1 inconnue par une solution d’hydroxyde de sodium (Na +(aq), HO–(aq)) de concentration apportée c = 5,00 × 10–2 mol·L–1. Donner sa constante d’équilibre. Ainsi, l’acide NH se transforme en sa base conjuguée NH 3 et la base HO – se transforme en son acide conjugué H 2 O.3)- Quotient de la réaction et sens d’écriture de la réaction. Donner la classe de l'alcool utilisé. Doser une solution, cela signifie déterminer sa concentration.Un acide carboxylique est un type de produit chimique.- Quelques grains de pierre ponce ou quelques billes de verre. A l’aide d’un tableau d’avancement, . Les solutions tampons peuvent être acides ou basiques. La solution diluée obtenue sera appelée S 1.L’équation de réaction acide-base est la suivante : NH (aq) + HO – (aq) NH 3 + H 2 O.
Exercice :On considère l'acide éthanoïque CH3CO₂H (ou acide acétique) et l'ammoniac NH3 .2)- Cas d’une réaction où le solvant intervient.on utilise un mélange équimolaire formé de n0 mole d'acide et n0 .
Écrire l'équation d'une réaction entre un acide et une base
Pour le tube « 𝑖 », le volume de la solution titrante versée à l’équivalence est noté 𝑉 ,𝑖.
Sur le côté gauche, l'acide . 2008Afficher plus de résultatsReaction entre l'acide ethanoïque et la soude - YouTubeyoutube.; Utitrage = 0 car le titrage se fait à la goutte près. Et on me demande de faire une hypothèse sur la nature de la trasformation chimique pour que la réaction puisse servir de support. Elle est caractérisée par un pH constant qui varie légèrement lors l'addition modérée d'un acide fort ou d'une base forte.
TSTL Ch3
Taille du fichier : 1MB
Chapitre 8 : Titrages acido-basiques
On prélève V 0 = 25,0 mL du mélange et on ajoute V 0 = 25,0 mL d’eau distillée dans un .
Titrage
Remarque : Pour cet équilibre, K correspond à la constante d'acidité du couple : CH 3 COOH / . Définir l’équivalence d’un titrage et en déduire la relation à l’équivalence. du vinaigre est effectuée.

Nous allons voir dans ce chapitre les dosages par titrage.

Le degré d’acidité d’un vinaigre correspond à la ma sse d’acide éthanoïque contenue dans 100 g de vinaigre.Dosage pHmétrique.K Mesure d’une constante d’acidité de l’acide éthanoïque K Mise en évidence de l’eet tampon avec l’acide éthanoïque K Simulations dozzzaqueux Table des matières 1 Notion d’acidité 2 1.comRecommandé pour vous en fonction de ce qui est populaire • Avis
Dosages par titrage direct 10 Extraits de sujets corrigés du bac S
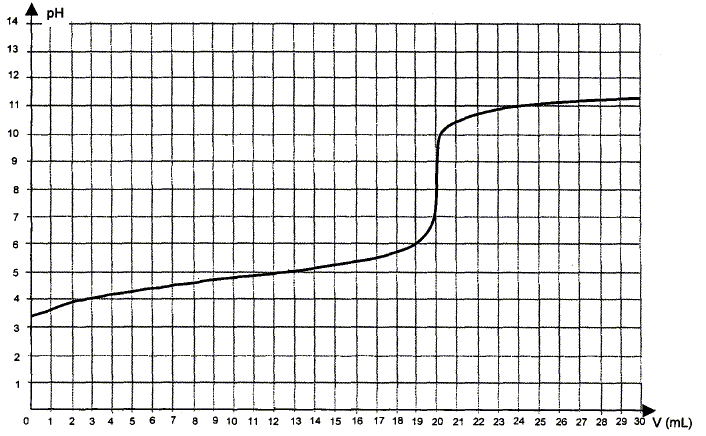
Quelles sont les espèces conjuguées de l'acide éthanoïque d'une part et de l'ammoniac d'autre part? Ecrire les couples acido-basiques correspondants. Les vinaigres du commerce ont un degré d’acidité de l’ordre de 6°. Synthèse de l'activité. Titrage d’un acide contenu dans le vinaigre 1. Pourquoi est-il possible de suivre ce titrage par conductimétrie ? 2. Les acides carboxyliques contiennent la fonction carboxyle : Voici les réactions que nous allons examiner.Pour déterminer KA, nous allons réaliser un titrage d’une solution d’acide éthanoïque (CH3COOH(aq)) par des ions hydroxydes (HO ), en suivant l’évolution du pH. Équivalence dans un titrage ; repérage de l'équivalence pour un titrage pH-métrique, conductimétrique et par utilisation d’un indicateur de fin de réaction.3 4 ) Faire un schéma annoté décrivant le dosage de l acide éthanoïque dans 2,0mL de mélange réactionnel par la solution de soude. 2010Reaction avec l'ion permanganate en milieu acide30 sept. Soude c B = 1,00 mol. → Le couple présent dans le vinaigre est . CH3-COOH aq + H2O (l) = CH3-COO- aq + H3O+aq. Principe : Le vinaigre d'alcool (6°, 8° ou 10°) peut se modéliser par une solution d'acide éthanoïque . 2020Enthalpie reaction de formation acide acetique7 avr.Equation de réaction de l'acide éthanoïque et de l'étnanol : acide éthanoïque ( CH3COOH) + éthanol ( CH3CH2OH) --> éthanoate d'étyle ( CH3COOCH2CH3) Questions: 1°) Calculer les. b)- Questions : pendant que la réaction s'effectue. Les méthodes de titrage peuvent donc être utilisées pour déterminer à la fois la concentration et le pKa .frDe l'acide ethanoique par la soude - OpenClassroomsopenclassrooms. On notera V 0 le volume d’acide éthanoïque prélevé initialement, et c 0 sa concentration. Ecrire l'équation de la réaction de l'acide éthanoïque avec l'eau.L -1 ) préparée va servir à doser l’acide éthanoïque contenu dans du vinaigre.Dans la figure 6.comRéaction acido-basique acide éthanoïque/hydroxyde de . Considérons une réaction entre la méthylamine et l'acide acétique : Premièrement, nous devons identifier les espèces acides des deux côtés de l'équation.Objectif général : vérifier le degré d'acidité d'un vinaigre du commerce par un titrage colorimétrique.B/Conditions sur la réaction de titrage Exemple Titrage de l'acide acétique par la soude : CH 3 COOH+OH = CH 3 COO +H 2 O La réaction de titrage doit être quantitative .NH 3(aq) + H 3 O +(aq) = NH 4+(aq) + H 2 O pour le dosage d'une solution d'ammoniac par une solution d'acide fort.La solution d’hydroxyde de sodium (de concentration 0,1 mol. Titrage avec un indicateur coloré 2.Donner la valeur du pH à l’équivalence pHE à l’aide du graphe. Une réaction acide-base a lieu lorsque l'acide d'un couple réagit avec la base d'un autre couple. Déterminer la concentration CA de la .l -1 Reste d'acide éthanoïque non consommé b ) Rendement de l'estérification 1 ) Écrire l'équation de la réaction d'estérification.4 (a), on peut voir que le point médian pour le pKa = 10 de l’acide faible se produit à pH = 10. Faire un tableau d’avancement qui fait apparaître le volume versé. Le vinaigre est une solution aqueuse contenant de l’acide éthanoïque.Titrage de l’acide éthanoïque. 1er cas : on veut titrer un acide complètement dissociée dans l’eau : Alors la réaction : HA (aq) + H 2O(l) = A-(aq) + H . En déduire le volume équivalent. Écrire l'équation de la réaction de titrage. Écrire l’équation chimique de la réaction entre l’acide acétique et l’ion hydroxyde, réac-tion support du titrage de la solution de vinaigre par la soude : 2.L'équation de la réaction de titrage d'un acide HA (aq) en solution par une base B (aq) en solution Doc.- Par convention, l’eau, solvant, n’intervient pas dans l’écriture de l’expression de Q r (même s’il intervient dans l’équation de la réaction). Tracer le diagramme de prédominance du couple acide .4 Réactions acido-basiques .Solution tampon : composant chimique. 10 10 10 20 10 20 10 10 20 10 20 I.Compléter le tableau d’avancement de la réaction ci-dessous : Conditions initiales : P et T ambiantes - 50 mL d’acide chlorhydrique - 5 g de NaHCO 3 Remarque : Ce TP marche . Le but de ce TP est de déterminer la concentration exacte en acide éthanoïque d’un tel vinaigre. L’acide éthanoïque, contenu dans le vinaigre, est un acide carboxylique : R C O O H H O () R C O O () H O () + + 2 – 3 + l a . Le dosage par titrage repose sur une équation chimique qui va faire intervenir deux solutions.
Titrages
1– Écrire l’équation de la réaction de titrage.L’acide acétique ou acide éthanoïque est un acide carboxylique avec une chaîne carbonée théorique en \ce {C2} CX 2, analogue à l’éthane, de masse molaire \pu {60 .Réaction d'estérification : verser le volume V_{1} d'acide éthanoïque pur, puis le volume d'acide sulfurique, tous deux à l'aide d'une pipette jaugée adaptée ; ajouter le volume V_{2} d'éthanol à l'aide d'une éprouvette, puis fixer sur l'erlenmeyer un tube réfrigérant et placer l'ensemble au bain‑marie à 50 °C pendant 45 minutes ;
TP N°9 : TITRAGE CONDUCTIMETRIQUE DU VINAIGRE
Cette réaction doit être rapide et totale.L'acide éthanoïque réagit partiellement avec l'eau selon la réaction d'équation : CH 3 COOH + H 2 O = CH 3 COO-+ H 3 O +; de constante de réaction K = 1,8. La réaction de titrage entre un acide et une base devra mettre en jeu au moins un acide fort ou une base forte afin que la réaction soit totale. Afficher la correction. On trouvera dans le chapitre réactions acido-basiques des exemples de bases fortes (solution de soude ou de potasse par exemple) ou d'acides forts (acide . à part Réaction support de titrage ; caractère quantitatif. En déduire l'influence des conditions initiales sur la valeur du quotient de réaction à l'équilibre, appelée plus simplement constante d'équilibre et notée K .Le titrage met en œuvre une réaction chimique ou biochimique (ou une interaction physicochimique ou biologique) entre le composé à doser (titré) et un réactif connu qui . • pente dans un titrage conductimétrique. Sachant que le volume à l'équivalence vaut 8,6 mL, déterminer la concentration de l'acide méthanoïque dans la solution. On ne peut donc pas utiliser cette réaction pour titrer une solution d'acide éthanoïque.Après avoir refroidi un tube pour stopper la réaction d’estérification, on procède au titrage de l’acide éthanoïque restant dans le tube à l’aide d’une solution d’hydroxyde de sodium de concentration , en présence de bleu de thymol. 1 , s'écrit : HA (aq) + B (aq) = A- (aq) + BH+ (aq)Titrages Manon LECONTE I -La réaction de titrage A/Les di érents types de titrages Dé nition Titrage direct : l'espèce à titrer réagit directement avec l'espèce titrante.Dans le cas d’un titrage acido-basique, il peut s’agir : de déterminer la concentration d’une base dans une solution aqueuse com-merciale ou non.comTP dosage vinaigre blanc - studylibfr.- Écrire l'équation de la réaction.Dosages par titrage direct.comRecommandé pour vous en fonction de ce qui est populaire • AvisDETERMINATION DU DEGRE D'ACIDITE D'UN VINAIGRE - . Avant de réaliser ce titrage, une dilution au dixième. Par exemple NH ou OH− ou CH . Remarque : Lors du dosage pH-métrique, le titrage se fait également à la goutte près étant donné que le saut de pH est . Métropole septembre 2022 sujet 1.Comparer les valeurs obtenues à partir des quatre solutions d'acide avec des concentrations initiales différentes.Réactions acido-basiques en solution aqueuse3 janv.Connaître les propriétés d’une réaction support de titrage.3 Rôle de l’eau .
- 20 mL d'acide acétique à 99 % (acide éthanoïque).
Constante d'équilibre
L’ acide éthanoïque réagit très peu avec l’eau donc la réaction totale qui a lieu est : CH 3 COOH (aq) → CH 3 COO -(aq) + H + ; HO -(aq) + H +(aq) → H 2 O.La réaction de titrage.- Exemple : réaction entre l’acide éthanoïque et l’eau. La première est la solution titrée, qui est la solution . énoncé de la séance deTravaux Pratiques de chimie sur le suivi pHmétrique d'une réaction acido-basique . La réaction support du titrage a .
Chimie 8 : Titrages acido-basiques
Volume versé à l’équivalence : V BE,S = 2.On dose un volume VA d’acide et on note VB(eq), le volume de soude versé à l’équivalence du dosage.
TP n°3 de chimie
Écrire la réaction support du .Ecrire l'équation de la réaction entre l'acide éthanoïque et l'eau.Je bloque sur un exercice de chimie concernant un titrage de de l'acide éthanoïque avec la soude. L'équation de réaction s'obtient à partir des .
Équation de réaction du titrage de l'acide ethanoique par la soude
Donner le nom usuel de l’acide éthanoïque.K eq (pour la réaction acide-base en question) = 10 ΔpKa. 2014réaction entre l'acide acétique et l'ammoniaque8 avr.La réaction acide-base.2 Acide et base de Brönsted . Exemple : titrage de l'acide acétique par la soude CH 3 COOH+HO = CH 3 COO +H 2 O. Réaliser le titrage et déterminer le volume . Ou ΔpKa Δ p K a est le pKa p K a de l'acide du produit moins pKa p K a d'acide réactif. Quelle définition donne t’on à un titrage ? 2. On veut réaliser le dosage pH-métrique d’un mélange d’acide fort, l’acide chlorhydrique, de concentration C 1 et d’acide éthanoïque (K a = 10-4;8 ~ 1,6 10-5) de concentration C 2 par une solution de soude de concentration C B = 0,100 mol/L. TP N°9 : TITRAGE CONDUCTIMETRIQUE DU VINAIGRE.











